基本介紹
- 中文名:碳定年法
- 原理:碳自然元素
- 特點:碳-12是最常見的同位素
- 形式:只有一個碳-14
作用原理,存在爭議,
作用原理
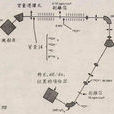
碳定年法的作用原理是:碳是大氣、地球、海洋和任何生物體內大量存在的自然元素。碳-12是最常見的同位素,約1兆碳原子中只有一個碳-14。在上層大氣中當氮-14(N-14)由於宇宙射線轟擊發生改變就產生碳-14(一個質子被中子所代替,有效地將氮原子變成碳的同位素)。這種新的同位素被叫做“放射性碳”,因為它具有放射性,不過沒有危險性。它自然是不穩定的,一段時間後會自發衰變為氮-14。半個放射性碳的樣本要衰變成為氮大約要有5,730年。其餘的碳的一半的衰變又要經過5,730年,再剩下的碳的一半又再要5,730年,依此類推。半個樣本衰變的時間被成為“半衰期”。
放射性碳氧化(即與氧結合)並通過呼吸飲食等過程進入生物圈。在動植物的生命過程里,其組織中自然地納入大量存在的碳-12同位素,同時也納入這種極其稀有的放射性同位素,其比例約和兩者在大氣中的比例是一樣的。當生物死亡時,它不再消耗放射性碳,而已經在它體內的碳-14會持續衰變為氮。所以,如果我們發現一個死亡生物遺體內的碳-12和碳-14的比例是應有比例的一半(即:一個碳-14比兩兆碳-12,而不是一比一兆),我們就可以認為這個生物死了約5,730年(因為一半的放射性碳沒有了,應該是用了5,730年衰變為氮)。如果比例是應有比例的四分之一(一比四兆),我們就認為這個生物死了11,460年(兩個半衰期)。經過大約10個半衰期後,剩下的放射性碳的數量就少到無法測量了,因此這種方法不適用於推斷60,000年前死去的標本年代。它的另一個局限是這種技術只能用於有機材料,如骨骼、肌體或樹木。它不能直接用作測定岩石。
存在爭議
對於碳定年法的爭議主要由於以下兩個原因:第一,它的先決條件是一系列不確定的假設。例如,我們必須假設衰變的速度(即5,730年的半衰期)在無法觀測的過去是恆定的。然而,有確定證據表明在無法觀測的過去,放射性衰變是大大加速的1。我們還必須假定大氣中碳-12和碳-14的比率在整個無法觀測的過去是恆定的(所以我們才能知道標本死亡時的比率)。但是我們知道,“放射性碳的形成比它的衰變要快28-37%” 2,這就意味著它未曾達到平衡,也就意味著現在的比率高於無法觀測到的過去的比率。我們還知道工業革命期間由於工廠二氧化碳排放的急劇增長造成這個比率下降。這種人為的浮動不是自然現象,但它表明浮動是有可能的,而且自然災變時期對地球的影響也可能大大影響這個比率。火山噴發的二氧化碳也可能同樣顯著地降低這個比率。如果這樣測算的話,在劇烈火山活動期間生存或死亡的標本看起來會比其實際年代久遠。這個比率還會受到大氣中產生碳-14的速度的影響,因為進入地球大氣的宇宙射線的數量會影響碳-14產生的速度。進入地球大氣的宇宙射線的數量本身也要受到地球磁場偏轉宇宙射線的影響。過去140年進行的精確測量表明了地球磁場力量的穩步衰減。這就意味著放射性碳的產生曾有穩步的增長(而這會提高比率)。
最後,這種定年方法頗受爭議還因為所測出的年代常常極不相符。例如,“迪瑪(1977年發現的一個著名的小猛獁象)的一部分測出是40,000RCY(放射碳年),而另一部分是26,000 RCY,而就在它旁邊發現的木頭的時間是9,000-10,000 RCY。(沃爾特·布朗,《世界之初》,2001年,176頁)