中國科學家率先解析結構奧秘,背景,1. DNA右手雙螺旋結構,2.我們人類的基因組,3. 染色質左手雙螺旋結構的確立,4. 染色質雙螺旋結構發現的科學意義,5. 中國科學院蛋白質科學研究,6. 中國科學院戰略性先導科技專項,
中國科學家率先解析結構奧秘
61年前的今天(1953年4月25日),英國劍橋大學卡文迪許實驗室的沃森和克里克在英國Nature雜誌上發表了一篇劃時代的論文,向世界宣告他們發現了DNA的雙螺旋結構,揭開了遺傳信息如何傳遞這個“生命之謎”。這個發現使生命科學的研究深入到分子層次,開啟了現代分子生物學時代,成為20世紀最偉大的科學發現之一。
人的基因組含有大概30億對鹼基,如果把這些鹼基對集中到一根DNA“繩子”上,它的長度大概是2米。2米長的DNA要安放在直徑只有幾個微米的細胞核里,必須以某種方式凝縮起來。在現代生物學的教科書里,這個過程是分四步完成的,這四個過程對應著四個結構:第一級結構是核小體,它是DNA雙螺旋“繩子”纏繞在組蛋白上而形成的;第二級結構是核小體進一步螺旋化形成30nm螺線管,這裡6個核小體組成一圈形成中空結構的管狀螺旋體,即30nm染色質纖維;第三級結構是由螺線管再進一步螺旋化成為直徑為0.4微米的筒狀體,也稱為超螺旋體;第四級結構就是可以在顯微鏡下看到的
染色體, 它是由超螺旋體進一步摺疊盤繞成的。通過以上四步,DNA的長度被凝縮了8400倍左右。以上關於DNA的凝縮模型是目前科學界關於DNA、染色質和染色體組成的基本認識,也是現代生命科學教科書的經典內容。
由於缺乏一個系統性的、合適的研究手段和體系,目前對於30nm染色質纖維這一超大分子複合體的組裝和調控機理的研究還十分有限,對於它的精細結構組成也具有很大爭議。近30多年來,30nm染色質纖維高級結構研究一直是現代分子生物學領域面臨的最大挑戰之一。 2014年4月25日(DNA雙螺旋結構發現61周年紀念日),國際頂尖研究雜誌Science上以長幅研究論文(Research Article)形式報導了來自中國科學院生物物理研究所一項關於30nm染色質高級結構解析的重大成果。中科院生物物理所長期從事冷凍電鏡三維結構研究的朱平研究員和長期從事30nm染色質及表觀遺傳調控研究的李國紅研究員通過多年的緊密合作和不懈努力,發揮各自專長和優勢,成功建立了一套染色質體外重建和結構分析平台,利用一種冷凍電鏡單顆粒三維重構技術在國際上率先解析了30nm染色質的高清晰三維結構,在破解“生命信息”的載體 -- 30nm染色質的高級結構研究中取得了重要突破。該結構揭示了30nm染色質纖維以4個核小體為結構單元;各單元之間通過相互扭曲摺疊形成一個左手雙螺旋高級結構(圖)。同時,該研究也首次明確了連線組蛋白H1在30nm染色質纖維形成過程中的重要作用。本研究論文的評審人評論說 “30nm染色質結構是最基本的分子生物學問題之一,困擾了研究人員30餘年”,該結果是“目前為止解析的最有挑戰性的結構之一”,“在理解染色質如何裝配這個問題上邁出了重要的一步”。
高等生物的遺傳信息儲存在染色體的DNA中,每一個體具有200多種不同細胞,這些細胞都是從單個受精卵細胞發育分化而來的,具有相同的遺傳信息,但是他們的形態和生理功能卻大相逕庭。研究表明,生命體通過調控細胞核內染色質結構(特別是30nm染色質高級結構)的動態變化來有選擇性地進行基因的激活和沉默,從而控制細胞自我維持或定向分化,決定細胞的組織特異性和細胞命運,進而形成複雜的組織、器官和個體。因此,研究染色質的高級結構及其調控機制對於理解細胞增殖、發育及分化過程中一些重要基因的表達差異及表觀遺傳學調控機理具有十分重大的意義。
本研究工作是中科院生物物理研究所朱平研究組、李國紅研究組、許瑞明研究組長期合作獲得的重要成果,得到了科技部973計畫,國家自然科學基金委重大研究計畫項目和重點項目以及中科院戰略性先導科技專項(B類)等的資助。
背景
1953年4月25日,英國劍橋大學卡文迪許實驗室的沃森(James Dewey Watson,1928-)和克里克(Francis Harry Compton Crick,1916-2004)在英國Nature雜誌上發表了一篇劃時代的論文,向世界宣告他們發現了DNA的雙螺旋結構,從而開啟了現代分子生物學時代,成為20世紀最偉大的科學發現之一。他們也因為這項開創性的研究與威爾金森分享了1962年的諾貝爾生理學或醫學獎。
然而,任何有關DNA的生命活動(包括基因轉錄、DNA複製、修復和重組等)都是在由DNA與其所纏繞的組蛋白組裝形成的染色質這個結構平台上進行的。近30來,染色質的三維結構研究一直是現代分子生物學領域面臨的最大的挑戰之一。最近,中國科學院生物物理研究所的科學家經過多年的不懈努力,在國際上首次解析了30nm染色質纖維的高解析度冷凍電鏡結構,提出了一種全新的染色質纖維的左手雙螺旋結構模型,在破譯“生命信息”建立和調控的分子機理研究中取得了重大突破。2014年4月25日(與DNA雙螺旋結構的發現同一天),該成果在國際頂尖雜誌Science上以長幅研究論文(Research Article)報導。
1. DNA右手雙螺旋結構
脫氧核糖核酸(DNA)是全部具有細胞結構的生物遺傳信息的載體。這個重要的的分子中儲存了生物體用來構建細胞的各種組件的“藍圖”。對於DNA的研究可以追溯到19世紀。1868年,瑞士醫生米歇爾(Friedrich Miescher, 1844-1895)以外科手術繃帶上的膿中分離出的白細胞為材料,發現了白細胞的細胞核中存在一種能在弱酸性溶液中析出而在弱鹼性溶液中溶解的白色絲狀物質,他把它命名為“核素(nuclein)”。這就是後來被人們所熟知的DNA。他還通過燃燒實驗證明核素中存在大量的有機磷元素。此外,他還發現很多其他的細胞組織中,如腎細胞、肝細胞中也都可以提取到這種物質。因為這種物質是從細胞核中提取的,而且具有酸性,因此人們又稱它為“核酸” 。
對於核酸組分和結構的研究到了二十世紀才取得比較大的進展。德國生化學家柯塞爾(Albrecht Kossel,1853-1927)的研究搞清楚了核酸是由五種不同的鹼基(腺嘌呤(A)、鳥嘌呤(G)、胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(U))及核糖、磷酸組成。柯塞爾因對細胞核化學組分的研究獲得了1910年的諾貝爾生理學醫學獎。1929年,俄裔生化學家利文(Phoebus Levene,1869-1940)又確定了核酸其實有兩種,一種是脫氧核糖核酸(DNA),另一種是核糖核酸(RNA)。到了1944年,埃弗雷、麥克利奧特及麥克卡蒂(Oswald T. Avery, Colin MacLeod 與 Maclyn McCarty)通過肺炎雙球菌的體外轉化實驗終於證明了DNA,而非蛋白質,才是遺傳信息的物質載體。接下來,研究界的目光立刻投向了對DNA結構的研究。
1951年,奧地利生化學家查戈夫(Erwin Chargaff,1905-2002)提出了著名的“查戈夫規則”,即幾乎所有類型的DNA,不管是來自哪種生物或組織細胞, 其中的腺嘌呤與胸腺嘧啶數量幾乎完全一樣,鳥嘌呤與胞嘧啶的數量也是一樣。這個規則的提出也為揭示DNA的結構鋪平了道路。1953年4月25日,受到了富蘭克林 (Rosalind Elsie Franklin,1920-1958)DNA 晶體X-射線衍射照片的啟發,英國劍橋大學卡文迪許實驗室的沃森(James Dewey Watson,1928-)和克里克(Francis Harry Compton Crick,1916-2004)在英國《Nature》雜誌上發表了一篇劃時代的論文,向世界宣告他們發現了DNA的雙螺旋結構。接著他們又在5月30日出版的《Nature》雜誌上發表了一篇題為“DNA的遺傳學意義”的文章。他們也因為這項開創性的研究與威爾金森分享了1962年的諾貝爾生理學或醫學獎。
DNA雙螺旋模型顯示DNA中四種鹼基排列在雙螺旋的內部,並以A-T、C-G的方式配對;脫氧核糖和磷酸基團排列在外部,通過磷酸二酯鍵交替連線起來。兩條主鏈以麻花狀繞同一螺旋軸以右手方向盤旋形成方向相反的雙螺旋。由於兩條主鏈上配對的鹼基並不在一個平面上而是有一定的交角,因此在雙螺旋表面形成了由大溝和小溝組成的兩種凹陷。DNA雙螺旋的直徑2 nm,沿螺旋軸上升一圈有10對鹼基;螺距為3.4 nm,相鄰鹼基對平面的間距為0.34 nm。雙螺旋結構顯示出DNA分子在細胞分裂時能夠以自我複製的方式將核苷酸序列中的信息完整的傳遞給子代分子,解釋了生物體要繁衍後代,物種要保持穩定,細胞內必須具有維持遺傳穩定性的機制。DNA雙螺旋結構也為人們提供了對DNA分子進行人工操作的結構基礎。自此,生命科學進入了分子生物學時代,在其後的幾十年中,以基因工程為代表的一系列分子生物學技術極大地改變了我們的日常生活。
2.我們人類的基因組
A. 我們每個人的基因組DNA大概有多長?
我們人類是二倍體生物,正常體細胞中含有兩套染色體組,一套來自於父方,一套來自於母方。我們每個個體的生命都是從一個精子和一個卵子相結合開始的。精子和卵子都是單倍體細胞,只含有體細胞中的一套染色體組。精子與卵子結合形成受精卵,成為二倍體細胞,含有兩套分別來自父母的完整染色體組。受精卵經過發育分化,形成萬億個各種功能各異的細胞;這些億萬個組織特異性的細胞有機地結合成為各種器官系統和不同組織,最後便形成一個嬰兒!對於人類的單倍體細胞(如精子或卵子),DNA分子組裝成23條染色體,一共含有30億個鹼基對(3×109個)。由於人類的體細胞是二倍體,這就意味著每個體細胞中含有46條染色體,其DNA量是由多達60億個鹼基對組成 [即 2 ×(3×109)= 6×109個] 。每個鹼基對的長度大約有0.34納米(1納米=10-9米)。如此推算,那么每個二倍體細胞中就應該有約2米長的DNA [(0.34×10-9)×(6×109)≈2米 ]。也就是說,我們身體中,一個體細胞的DNA長度加起來約有2米。
據估算我們每個人體內大約含有50萬億個細胞(即50×1012), 那么體內含有DNA總長應該為100萬億米長[(50×1012)×2 =100×1012米]。太陽距地球大概1500億米(1.5億公里),一個來回就是3000億米(3億公里)。將人體DNA分子連線起來,其長度相當於地球到太陽來回距離的300倍,[(100×1012)÷(300×109)=330≈300]。
B。我們的人體和細胞怎么容下這么長的基因組DNA?
我們上面介紹了人體細胞中的DNA長度:每個二倍體細胞中的DNA加起來有2米長。如果粗略的按46條染色體測算,每條染色體包含的DNA長度平均是4厘米左右。(需要說明的是,不同染色體大小是有差異的;這裡僅作粗略測算,是為給大家一個形象的說明,以方便理解)。
接下來,一個重要的問題是,這么長的基因組DNA到底包藏躲在人體或細胞的什麼地方?有趣的是,科學家們發現我們的DNA主要被包裝在細胞核內中的染色質里。另外,構成我們人體的細胞,形態大小各異,大的細胞如卵子直徑可以達到130 微米左右,小一些的細胞直徑只有5~6 微米。而那么我們的2米長的基因組DNA分子又是怎樣組裝、緊密壓縮到10-20微米的細胞核空間內的呢?細胞中有一類性質特異的蛋白質,組蛋白八聚體,能夠組裝基因組DNA形成染色質,並進一步摺疊凝聚形成非常複雜的染色質三維結構,把基因組DNA壓縮到真核生物的細胞核內。
2. 染色質的三維結構
在真核細胞中,DNA總是以染色質的形式存在,每一個細胞都有約2米長的DNA鏈通過染色質緊密摺疊被包含在幾個微米的細胞核里。染色質早在1879年就被德國生物學家弗萊明Flemming提出,用於描述細胞核中已被鹼性染料染色的物質。其在細胞有絲分裂期高度摺疊形成染色體。
染色質是遺傳物質基因的主要載體,是調節生物體新陳代謝、遺傳和變異的物質基礎。所有有關DNA的生命活動都是在染色質這個結構基礎上進行的:染色質使基因組DNA有序組織在有限大小的細胞核內;同時保證細胞分裂過程中DNA的有序分離;保護DNA以有效防止DNA損傷;並控制基因的轉錄活性。
雖然染色質的概念早在1879年就被提出,但是直到一百年後的1974年,Kornberg利用生物化學和電鏡成像技術,才發現染色質的一級結構,即由DNA串聯的11nm核小體串珠結構。核小體是染色質結構的基本單元,由147bpDNA纏繞組蛋白八聚體(由四種組蛋白H2A、H2B、H3和H4各兩個分子組成的扁球狀八聚體)1.75圈組成,其高精度精細結構於1997年被Richmond研究組解析。染色質一級結構摺疊形成染色質二級結構“30nm染色質纖維”。教科書上認為30nm染色質纖維是染色質一級結構經螺旋化形成每一周包含6個核小體的螺旋管線狀體。但是由於30nm染色質纖維的精細結構一直沒有被解析,其結構模型目前仍然存在著很大的爭議。染色質二級結構再進一步摺疊形成更為複雜的染色質高級結構,從而實現將長達2米的基因序列有規律的歸集在微米級的細胞核中。
除了細胞核中染色質的整體組織形式受到細胞周期調控以外,其局部結構也是高度動態的,受各種表觀遺傳因素的調控,包括組蛋白變體,DNA和組蛋白化學修飾等。染色質結構的動態調控與其相關基因的活性密切相關:染色質結構緊密,阻礙DNA與各種轉錄因子或DNA修復因子的作用,從而抑制基因活性;另一方面,染色質結構鬆散暴露DNA,使得基因活性被激活。
3. 染色質左手雙螺旋結構的確立
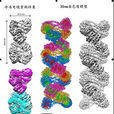
30nm染色質冷凍電鏡結構及左手雙螺旋結構模型
長期以來,對多個核小體以何種方式裝配形成30nm染色質高級結構,以及該結構受什麼因素調控一直是研究者夢寐以求,對生命信息的傳承和調控至關重要的信息。正如本研究論文評審人指出的:“30nm染色質結構是最基本的分子生物學問題之一,困擾了研究人員30餘年”。這個問題的困難性主要來源於兩個方面:第一,細胞核內的染色質結構高度變化,受多種因素的影響,難以獲得適合高解析度結構研究、具有高度均一性的染色質樣品;第二,30nm染色質是一個典型的超大分子複合體,對這種超大分子複合體的高解析度研究缺乏一個系統性的、合適的研究手段和體系,具有極大的技術難度和挑戰性。因此,目前對於30nm染色質纖維這一超分子複合體的組裝和調控機理的研究還十分有限,對於30nm染色質纖維的精細結構及其結構模型的理解都還十分不確定並具有很大爭議。對於第一個方面的困難,研究者通過多年的努力,發現利用體外表達一種具有特殊性質的601DNA和組蛋白八聚體,可以獲得適合高解析度研究的核小體和染色質;同時,通過改變不同的組蛋白修飾、組蛋白變體、不同的連線DNA長度等多種條件可以對各種影響染色質結構及動態變化的複雜因素在體外進行相關研究;對於第二方面的困難,近年來在結構生物學領域蓬勃發展,並在近原子解析度三維結構重構方面取得重要性突破的一種冷凍電鏡三維重構方法為研究30nm染色質的高級結構提供了一個最為合適的工具。
中國科學院生物物理研究所長期從事冷凍電鏡高解析度三維結構研究的朱平研究員和長期從事30nm染色質及表觀遺傳調控研究的李國紅研究員發揮各自特長,對這一難題進行了緊密合作和長期攻關。李國紅研究組依據多年在30nm染色質和表觀遺傳學研究方面的長期積累,成功建立了一套染色質體外重建和結構分析平台,獲得了適合高解析度研究的高度均一30nm染色質樣品;朱平研究組依靠在冷凍電鏡高解析度結構解析方面的長期積累,利用冷凍電鏡單顆粒三維重構方法獲得了由12個和24個核小體組成的30nm染色質纖維的高解析度三維重構結果。這是兩個研究組緊密合作,在世界上首次解析的染色質清晰高級結構圖。他們解析的結構揭示了30nm染色質纖維以4個核小體為結構單元相互扭曲形成;結構單元的形成和單元之間的扭轉由不同方式的作用力介導;四聚核小體結構單元之間的空隙可能是組蛋白修飾、染色質重塑等重要表觀遺傳現象發生的調控控制區域。同時,他們的研究發現連線組蛋白H1在單個核小體內部及核小體單元之間的不對稱分布及相互作用促成30nm高級結構的形成,首次明確了連線組蛋白H1在30nm染色質纖維形成過程中的重要作用。同時,和長期從事X射線晶體學研究的結構生物學家許瑞明研究員研究組合作,他們發現各個四聚核小體單元之間通過相互扭曲摺疊成為一個和DNA右手雙螺旋類似的左手雙螺旋染色質纖維高級結構(圖)。這些研究結果對於30nm染色質纖維高解析度結構精細模型建立這一重大科學難題的破解,以及對於染色質的高級結構組裝的分析及表觀遺傳調控機制的研究是一個重要的突破性進展,並為預測體內染色質結構建立的分子基礎以及各種表觀遺傳因素包括組蛋白變體、組蛋白化學修飾等對染色質結構調控的可能機理提供了可靠的結構基礎。
4. 染色質雙螺旋結構發現的科學意義
高等生物的遺傳信息儲存在染色體的DNA中,每一個體具有200多種不同細胞,這些細胞都是從單個受精卵細胞發育分化而來的,具有相同的遺傳信息,但是每種細胞的表型和功能都不一樣。一個重要生物學問題就是具有相同基因組的同一個體中不同功能的各種細胞的命運是如何決定的。雖然十年前科學家就獲得了人類基因組序列的線性圖譜,但是某些問題我們仍未解開——除了眾所周之的DNA雙螺旋結構,基因組是如何準確摺疊的呢?基因組摺疊的方式決定了哪些基因開啟,哪些基因關閉,因此研究基因組三維結構可以解釋基因組如何運作。最近研究表明細胞命運的決定主要是通過表觀遺傳機制有選擇地進行基因沉默和基因激活來實現的,從而控制細胞自我維持或定向分化,決定細胞的組織特異性和細胞命運,從而形成複雜的組織、器官和生命體。另外,大量研究表明表觀遺傳調控機制是生命現象中的一種普遍存在的調控方式,涉及生命現象的方方面面,在幹細胞維持和自我更新與分化,個體的衰老和發育異常,如腫瘤、糖尿病、精神病及神經系統疾病等複雜疾病的發生髮展中起著決定性的作用。
表觀遺傳及其調控機制是當今生命科學的一個重要的前沿和熱點領域。表觀遺傳信息被建立後,通常認為並不直接影響轉錄,而是通過影響染色質高級結構或者在效應蛋白的幫助下影響染色質高級結構的動態變化,來實現對基因表達的調控從而實現對基因表達的調控。然而表觀遺傳信息怎樣影響染色質的高級結構則長期以來所知甚少,以至於在眾多文獻中研究者們常常把不能解釋的一些事件歸咎為“該因子以某種方式改變了染色質的高級結構”。而染色質的高級結構變化也成了科學界的一個“黑箱”。染色質的高級結構的第一級形態是染色質的30納米纖維。在教科書中,30納米纖維被描述為“螺線管 (solenoid)”,但該結構從未被正式以結構生物學手段得到解析,是染色質和表觀遺傳學領域長期以來的高難度科學問題。由於30納米染色質纖維本身的結構都未被解析,表觀遺傳信息對其結構乃至更高級染色質結構的影響更是無從談起。
30nm染色質纖維是由核小體-核小體有序堆積而成。近30年來,30nm染色質纖維結構受到廣泛的關注,大量的生物化學和生物物理學技術,如電鏡、小角度X-ray散射、中子散射、圓二色譜等被用來研究30nm染色質纖維的結構。鑒於染色質結構的複雜性和研究手段的局限性,目前在染色質的高級結構及調控領域缺乏一個系統性的、合適的研究手段和體系,對於30nm染色質纖維這一超分子複合體的組裝、精細結構和調控機理的都不是十分清楚。雖然核小體自身的高分辨晶體結構已被解析,但是目前對於30nm染色質纖維的認識還是相當有限,特別是對30nm染色質纖維精細結構的解析、30nm 染色質纖維的組裝和調控機理、及其結構動態變化在基因轉錄調控中的作用機理的研究還處於起步階段。因此,30nm染色質纖維的三維結構研究一直是現代分子生物學領域面臨的最大的挑戰之一。
中國科學院生物物理研究所充分發揮多學科交叉的傳統優勢,緊緊圍繞蛋白質科學領域的基礎性、前沿性重大科學問題開展持續深入研究。面向2020年,生物物理研究所明確提出“一個定位、三個重大突破、五個重點培育”的重點發展規劃,將“真核膜蛋白和蛋白質複合體結構與功能關係”列為三個重大突破方向之一。設立了“染色質結構和細胞命運決定的機理研究”一三五目標導向團隊,組織在染色質功能、表觀遺傳調控、高解析度冷凍電鏡三維重構、X-射線晶體學等研究領域的研究隊伍,增加穩定支持,促進團隊成員之間的分工協作。在中國科學院戰略性先導科技專項(B類)“生物超大分子複合體的結構、功能與調控”的重點支持下,在中科院蛋白質科學平台(已整體納入國家蛋白質科學北京設施)的全面支撐下,對30nm染色質高級結構這一重大科學難題展開聯合攻關。首次利用冷凍電鏡單顆粒三維成像技術解析了由12個核小體和24個核小體組成的30納米染色質纖維的高級精細結構。這是分子生物學領域內國際領先的突破性前沿成果,為解析人類重要疾病(如腫瘤和衰老)發生和發展的分子機理,探討重要疾病的治療及藥物研發提供重要的理論指導。
通過以上研究,我們在國際上率先打通了30納米染色質結構解析的道路,這為該研究團隊繼續研究表觀遺傳信息對30納米染色質結構的影響提供了得天獨厚的競爭優勢。這一重大突破使得我們研究團隊有望成功回答染色質修飾(包括DNA甲基化和組蛋白修飾)、染色質變體組成等一系列表觀遺傳信息對30納米染色質纖維的結構影響,這些工作將對學科的發展起到重要的引領作用,從而使我國在染色質三維結構這個領域處於國際領先地位。同時,研究染色質三維結構及其調控機制對於理解細胞增殖、發育及分化過程中一些重要基因的表達差異及表觀遺傳學調控機理具有十分重大的意義,對提升我國在幹細胞和表觀遺傳學等領域的研究水平也有促進作用。
5. 中國科學院蛋白質科學研究
中國科學院蛋白質科學研究歷史悠久、實力雄厚,1965年上海生化所等首次人工全合成了蛋白質——結晶牛胰島素,1972年生物物理所等解析了國內第一個生物大分子——胰島素的高解析度晶體結構。近年來,菠菜主要捕光複合體的晶體結構解析實現了我國膜蛋白結構解析零的突破,線粒體膜蛋白複合體Ⅱ的三維結構研究則填補了我國線粒體結構生物學和細胞生物學領域的空白,上述成果均為領域內公認的里程碑量級的原創性工作。
長期以來,我院已形成一支在國內外有影響力的蛋白質科學研究隊伍,其中兩院院士11人、千人計畫8人、傑出青年15人、青年千人計畫8人、百人計畫40人,優秀研究員隊伍100多人。以兩院院士牽頭、千人計畫領軍,傑出青年、青年千人計畫、百人計畫為骨幹的極具創新活力的研究團隊是我院蛋白質科學研究的堅實基礎。
在重大設施建設方面,國家高瞻遠矚地批准了國家蛋白質科學研究設施建設項目,中科院的上海生科院、生物物理所是建設主力。2008年11月14日,國家發展和改革委員會批准國家重大科技基礎設施項目——國家蛋白質科學研究設施的項目建議。在此項批覆中明確了國家蛋白質科學研究設施的主要建設任務為:(一)由軍事醫學科學院作為項目法人單位,清華大學、北京大學、生物物理所為共建單位,在北京市建設以蛋白質組學研究能力為主的蛋白質科學研究設施。(二)由中國科學院上海生命科學研究院作為項目法人,在上海市建設以蛋白質結構解析能力為主的蛋白質科學研究設施。在此基礎上中科院院已批准成立“中國科學院蛋白質科學中心”,中心下設“中國科學院蛋白質科學中心(北京)”和“中國科學院蛋白質科學中心(上海)”。北京中心依託生物物理所現有的蛋白質科學平台和國家蛋白質北京設施(生物物理所部分),上海中心依託國家蛋白質上海設施及上海光源兩個重大科學設施。兩個中心有效聯合,相互補充,南北呼應,在中科院統一領導下,通過一體化協同運行,構成了中科院蛋白質科學研究的整體布局。
生物物理研究所中長期規劃中將“真核膜蛋白和蛋白質複合體結構與功能關係”、“建立認知基本單元的理論框架”、“生物成像瓶頸技術突破”等列為三個重大突破方向,將“疾病發生與干預的蛋白質結構基礎”、“認知的分子神經基礎及認知障礙”、“抗病毒新靶點與防治新策略”、“非編碼RNA的系統發現與功能結構”、“新型抗腫瘤生物技術藥物”等列為五個重點培育方向。生物物理所的蛋白質科學研究主要分為三個方向:結構生物學、生物膜與膜蛋白,蛋白質合成與調控,凝練出重點發展方向,圍繞膜蛋白結構和功能,染色質結構、表觀遺傳調控與細胞命運決定,細胞內膜系統形成及其穩態維持的調控機制,疾病發生與防禦的蛋白質結構和功能基礎,蛋白質的生成、修飾與質量控制等五個方向開展研究。
6. 中國科學院戰略性先導科技專項
中國科學院戰略性先導專項包括前瞻戰略科技專項(A類先導專項)和基礎與交叉前沿方向布局(B類先導專項)兩類。A類先導專項側重於突破戰略高技術、重大公益性關鍵核心科技問題,促進技術變革和新興產業的形成發展,服務我國經濟社會可持續發展。B類先導專項側重於瞄準新科技革命可能發生的方向和發展迅速的新興、交叉、前沿方向,取得世界領先水平的原創性成果,占據未來科學技術制高點,並形成集群優勢。
B類先導專項由前沿科學與教育局負責策劃、組織實施和管理。目前B類先導專項已啟動實施10項,擬啟動實施5項,十二五期間計畫共啟動20項。“生物超大分子複合體的結構、功能與調控”先導專項於2014年3月17日正式啟動實施,專項共有3個項目,9個課題,26個子課題,共33名核心成員。專項依託單位為生物物理所,專項承擔單位共8個,分別為生物物理所、上海生科院、中科大、微生物所、上海藥物所、高能物理所、遺傳發育所、套用物理所。專項首席科學家為饒子和院士。超大分子複合體先導專項瞄準“生物超大分子複合體的組裝調控與細胞生命過程關係”這一關鍵科學問題,以期在原子水平上重現細胞中的動態生命過程,力爭攻克若干超大分子複合體的世界性難題,產生里程碑式的重大科學成就。同時,瞄準關鍵技術瓶頸突破,建立超大分子複合體高解析度結構和動態構象研究的技術體系,為重大原創性工作的產出提供技術支撐。