基本介紹
- 中文名:玻爾半徑
- 外文名:Bohr radius
- 套用學科:物理學
數值及定義,物理意義,
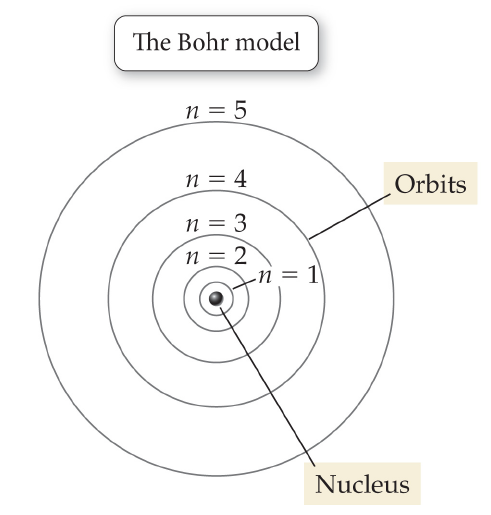
尼爾斯·玻爾(Niels Bohr)於1913年提出了原子構造的玻爾模型(Bohr model),其中電子環繞著原子核運轉。模型中提及電子只會在特定的幾個距離(視能量而定)環繞原子核運轉。而最簡單的原子──氫原子──只有一個電子軌道,該軌道也是電子可運行的最小軌道,其能量是最小的,從原子核向外找到此軌道的最可能距離就被稱為玻爾半徑(Bohr radius)。
在玻爾理論中是氫原子處於基態時電子繞核運行所作的圓軌道的半徑。是氫原子最靠近原子核的電子軌道的半徑。是原子物理學中的一種長度單位。常用a表示。常用以衡量原子的大小。

數值及定義
根據科學技術數據委員會(CODATA)2014年的數據,玻爾半徑的值為5.2917721067(12)×10^-11米(即約53皮米或0.53埃格斯特朗)。括弧內數字(12)代表最後數位的不確定度。此值能用其他物理常數計算出:
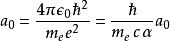
物理意義
要注意的是玻爾半徑並沒有包括約化質量的效應,所以在其他包括了約化質量的模型中,並不能準確地等於氫原子電子的軌道半徑。這是為了方便而設的:上述方程定義的玻爾半徑適用於氫原子以外的其他原子,而它們的約化質量修正值都不同。如果玻爾半徑包括了氫原子的約化質量,就有需要加入一個複雜的修正值來使方程適用於其他原子。
電子的玻爾半徑是一組三個互相關聯的長度單位中的一個,其他兩個是電子的康普頓波長λ及經典電子半徑re。玻爾半徑是由電子質量me,約化普朗克常數h bar及電子電荷e所得出的。這三個長度單位中的任一個都能用其餘兩個及精細結構常數α表示。
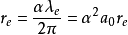

其中
- λp 為質子的康普頓波長
- λe為電子的康普頓波長
- α為精細結構常數
在上述方程中,約化質量(Reduced mass)所產生的效應由增加的康普頓波長表示,即電子及質子的康普頓波長之和。