基本介紹
- 中文名:熱力學能
- 外文名:internal energy
- 實質:狀態函式
- 國際單位:焦耳(J)
公式原理
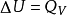
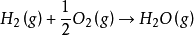
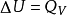
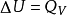
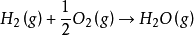
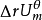
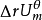
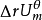
內能改變
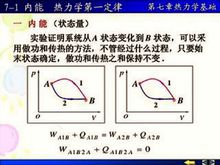

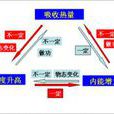
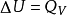
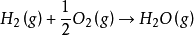
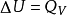
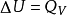
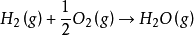
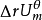
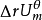
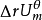


熱力學能,過去長期叫內能,符號U,是系統內各種形式能量的總和,例如系統中分子的動能(分子運動包括平動、轉動和振動三種形式)、分子內電子運動的能量、原子核內的...
熱力學總能:物質內部擁有的能量成為熱力學能。...... 熱力學總能:物質內部擁有的能量成為熱力學能。 目錄 1 系統總能 2 外部儲存能 熱力學總能系統總能 編輯 ...
熱力學(thermodynamics)是從巨觀角度研究物質的熱運動性質及其規律的學科。屬於物理學的分支,它與統計物理學分別構成了熱學理論的巨觀和微觀兩個方面。熱力學主要是從...
熱力學自由能(英語:Thermodynamic free energy)是指一個熱力學系統的能量中可以用來對外做功的部分,是熱力學態函式。自由能可以作為一個熱力學過程能否自發進行的判據...
原則上講,物體的內能應該包括其中所有微觀粒子的動能、勢能、化學能、電離能和原子核內部的核能等能量的總和,但在一般熱力學狀態的變化過程中,物質的分子結構、原子...
熱力學定律是描述物理學中熱學規律的定律,包括熱力學第零定律、熱力學第一定律、熱力學第二定律和熱力學第三定律。其中熱力學第零定律又叫熱平衡定律,這是因為...
熱力學第一定律是能量守恆定律。 熱力學第二定律有幾種表述方式: 克勞修斯表述為熱量可以自發地從溫度高的物體傳遞到溫度低的物體,但不可能自發地從溫度低的物體...
物體的熱力學性質是指物質處於平衡狀態下壓強P、體積V、溫度T、組成以及其他的熱力學函式之間的變化規律。...
熱力學作為物理學的一個分支,是研究物質的熱運動、性質及其規律的學科。在我們的日常生活和工業生產實踐中到處充滿了熱力學定律套用的實例。熱力學是理工科,比如物理...
熱力學第一定律(the first law of thermodynamics)就是不同形式的能量在傳遞與轉換過程中守恆的定律,表達式為△U=Q-W。表述形式:熱量可以從一個物體傳遞到另一...
為在環境的作用下,系統從一個平衡狀態變化到另一個平衡狀態的過程。在化工熱力學中,對熱力學過程的描述包括系統狀態的變化、經歷的途徑以及系統與環境間能量的交換...
套用熱力學常用來判斷凝聚態系統化學反應過程的方向性,以及固相反應過程生成序和產物穩定性。系統的多相性以及凝聚相中質點擴散速度小致其使難以達到熱力學意義上的...
化學熱力學是物理化學和熱力學的一個分支學科,它主要研究物質系統在各種條件下的物理和化學變化中所伴隨著的能量變化,從而對化學反應的方向和進行的程度作出準確的...
《熱力學》是王竹溪的精心之作。《熱力學》的取材和寫法與其他熱力學書很不同,有四個突出的特點:第一,具有高度的科學性、系統性和完整性,對熱力學的主要內容...
熱力學狀態(英語:Thermodynamic state)是指一組描述熱力學系統的狀態。個別的參數一般會稱為狀態變數、狀態參數或是熱力學變數。只要一熱力學系統中有足夠多的已知...
熱力學分析通常包括三方面的內容:(1)確定過程中工質狀態變化的規律以及相應的狀態參數;(2)確定過程中能量轉換的數量關係;(3)揭示過程中的不可逆程度,反映能量轉換...
熵,熱力學中表征物質狀態的參量之一,用符號S表示,其物理意義是體系混亂程度的度量。...
熱力學是研究熱現象中,物質系統在平衡時的性質和建立能量的平衡關係,以及狀態發生變化時,系統與外界相互作用的學科。 工程熱力學是熱力學最先發展的一個分支,它...
《熱力學分析與節能》作者陳文威,科學出版社出版。...... 熱力學分析與節能內容介紹 編輯 本書套用熱力學基本原理,闡述流體的熱力學性質及平衡,並對化工過程進行節...
統計熱力學是巨觀熱力學與量子化學相關聯的橋樑。通過系統粒子的微觀性質(分子質量、分子幾何構型、分子內及分子間作用力等),利用分子的配分函式計算系統的巨觀性質。...
經典熱力學(巨觀熱力學)以熱力學三個定律為基礎,利用熱力學數據,研究平衡系統各巨觀性質之間的相互關係,揭示變化過程的方向和限度。它不涉及粒子的微觀性質。...
技術發展 隨著計算技術的發展,通過解算複雜模型得到化學平衡數據及其它熱力學數據已成為現實,大量優秀的基於吉布斯能最小化的相圖計算軟體及其配套資料庫的開發取得了...
過程熱力學分析(thermodynamic analysis of process )是指化工熱力學的一項研究內容,即套用熱力學第一定律和第二定律分析化工過程,以確定在過程中有效能損失的數璜、...
熱力學第二定律(second law of thermodynamics),熱力學基本定律之一,克勞修斯表述為:熱量不能自發地從低溫物體轉移到高溫物體。開爾文表述為:不可能從單一熱源取熱...
