基本介紹
- 中文名:熱力學第三定律
- 外文名:the third law of thermodynamics
- 提出人:瓦爾特·能斯特
- 用途:穩定平衡狀態
- 套用學科:熱力學
- 適用領域:物理化學領域
原理簡介
定律相關
潛熱
熱膨脹係數
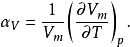

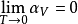
理論發展
 熱力學定律
熱力學定律
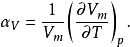

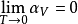
 熱力學定律
熱力學定律熱力學第三定律是熱力學的四條基本定律之一,其描述的是熱力學系統的熵在溫度趨近於絕對零度時趨於定值。而對於完整晶體,這個定值為零。由於這個定律是由瓦爾特·...
熱力學第一定律是能量守恆定律。 熱力學第二定律有幾種表述方式: 克勞修斯表述為熱量可以自發地從溫度高的物體傳遞到溫度低的物體,但不可能自發地從溫度低的物體...
熱力學定律是描述物理學中熱學規律的定律,包括熱力學第零定律、熱力學第一定律、熱力學第二定律和熱力學第三定律。其中熱力學第零定律又叫熱平衡定律,這是因為...
熱力學第零定律為定義和標定溫度奠定了基礎;熱力學第一定律定義了態函式內能;第二定律引進了態函式熵和熱力學溫標;熱力學第三定律則描述了系統的內能和熵在絕對...
經過許多科學家兩百年的努力,到1912年,能斯脫提出熱力學第三定律後,人們對熱的本質才有了正確的認識,並逐步建立起熱學的科學理論。...
熱力學三零定律熵及熵增原理 編輯 克勞修斯首次從巨觀角度提出熵概念(S=Q/T),而後波爾茲曼又從微觀角度提出熵概念(S=klnW),其兩者是相通的,近代的普里戈金提出了...
化學熱力學是建立在熱力學三大定律基礎上,從三大定律出發,用數學方法加以演繹推論,就可得到描寫物質體系平衡的熱力學函式及函式間的相互關係,再結合必要的化學數據,...
熵的絕對值不能由熱力學第二定律確定。可根據量熱數據由第三定律確定熵的絕對值,叫規定熵或量熱法。還可由分子的微觀結構數據用統計熱力學的方法計算出熵的絕對...
智力學第三定律:與量既有上限,也有下限;慧度沒有上限,但是卻存在下限。...... 對比之下,熱力學第三定律指出,溫度存在著下限,即絕對零度。目前科學界對溫度是否...
理論熱力學是理論研究物質的熱性質及其熱運動規律的一門學科,熱力學四大定律是在熱力學發展的過程中產生的。自然界與熱有關的一切現象都遵從熱力學四大定律。熱力學...
3.4 熱力學溫標3.5 熵3.6 熵增加原理3.7 熱力學第二定律的統計意義閱讀材料一、熱力學函式二、熱力學第三定律思考題三習題三第四章 分子熱運動的統計規律...
熱力學作為物理學的一個分支,是研究物質的熱運動、性質及其規律的學科。在我們的日常生活和工業生產實踐中到處充滿了熱力學定律套用的實例。熱力學是理工科,比如物理...
熱力學方法是從物質的巨觀物理量,例如壓力、溫度和熱量等方面來研究物質性質和變化規律的方法。熱力學理論以三個定律為出發點。熱力學第一定律闡明內能、熱量和功...
如果兩個熱力學系統中的每一個都與第三個熱力學系統處於熱平衡(溫度相同),則它們彼此也必定處於熱平衡。這一結論稱做“熱力學第零定律”。熱力學第零定律(英語...
《熱力學》是王竹溪的精心之作。《熱力學》的取材和寫法與其他熱力學書很不同,有四個突出的特點:第一,具有高度的科學性、系統性和完整性,對熱力學的主要內容...
傅立葉定律是法國著名科學家傅立葉在1822年提出的一條熱力學定律。該定律指在導熱過程中,單位時間內通過給定截面的導熱量,正比於垂直於該截面方向上的溫度變化率...
經典熱力學中的溫度沒有極限高溫度的概念,只有理論最低溫度“絕對零度”。熱力學第三定律指出,“絕對零度”是無法通過有限次步驟達到的。在統計熱力學中,溫度被...
