基本介紹
- 中文名:溶解焓
- 條件:在一定溫度壓力下
- 定義:純溶質溶解在純溶劑中溶液的焓變
- 符號:△solH
- 標準摩:標準壓下溶解焓與其物質的量之比
- 溶解焓的變:系統在溶解過程所吸收熱量的度量
原理,作用,用例,
原理
溶解焓是熱力學中表示物質系統能量的一個狀態函式,常用符號△solH表示。溶解焓的變化是系統在溶解過程中所吸收的熱量的度量。 物體中所有分子做熱運動的動能和分子勢能和分子、原子內部所具有的能量等的總和叫做物體的熱力學能,也叫做內能。熱力學能與動能、勢能一樣,是物體的一個狀態量。 在標準壓力pθ=100kPa下B的溶解焓與其物質的量n之比,稱為B的標準摩爾溶解焓,因此: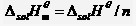
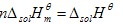
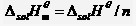
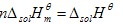
一定溫度下溶質的標準摩爾溶解焓除了與溶劑的種類有關外,還是溶液組成的函式。
積分溶解焓是在標準壓力和一定溫度下,1mol溶質溶於一定量的溶劑中所產生的熱效應,可以由實驗直接測得.壓力對摩爾積分溶解焓的影響是很小的。
微分溶解焓是標準壓力和一定溫度下,1mol溶質溶於大量某濃度的溶液中所產生的熱效應,需要通過作圖法求得.摩爾微分溶解焓是在溶液組成不變的條件下,向溶液中加入溶質溶解後的焓變與加入的溶質的物質的量之比。
作用
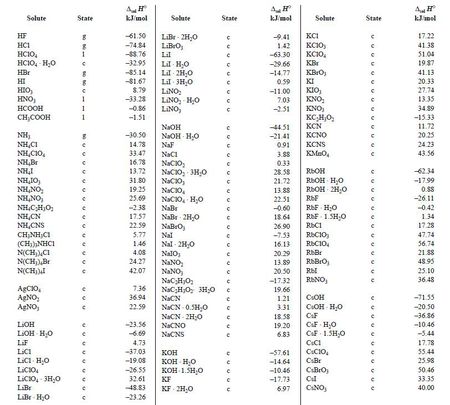
用例
1/r | 2.79 | 3.13 | 3.57 | 4.00 | 4.76 | 5.88 | 7.69 |
△solHm(kJ/mol-1) | -19.347 | -21.221 | -23.380 | -25.083 | -27.393 | -29.560 | -31.485 |
1/r | 12.5 | 20.0 | 50.0 | 100 | 200 | 400 | ∞ |
△solHm(kJ/mol-1) | -33.535 | -34.581 | -35.564 | -35.941 | -36.233 | -36.43 | -36.89 |