游離基反應,又稱自由基反應。按照化合物分子中的共價鍵(共用電子對)平均分裂成游離基的歷程而進行的反應。通常是輻射、燃燒或由過氧化物和熱分解所引起的變化。游離基反應具有重要的實際意義。例如氯化氫的合成、汽油的燃燒、單體的游離基聚合等都是游離基反應。
基本介紹
- 中文名:游離基反應
- 外文名:free radical substitution
- 定義:自由基參與的各種化學反應
- 所屬學科:化學
- 屬性:化學反應
簡介
分類
特點
反應本質
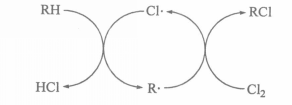 鏈反應歷程循環圖
鏈反應歷程循環圖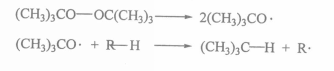 載鏈體
載鏈體
游離基反應,又稱自由基反應。按照化合物分子中的共價鍵(共用電子對)平均分裂成游離基的歷程而進行的反應。通常是輻射、燃燒或由過氧化物和熱分解所引起的變化。游離基反應具有重要的實際意義。例如氯化氫的合成、汽油的燃燒、單體的游離基聚合等都是游離基反應。
 鏈反應歷程循環圖
鏈反應歷程循環圖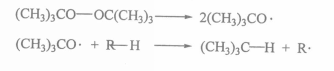 載鏈體
載鏈體游離基反應,又稱自由基反應。按照化合物分子中的共價鍵(共用電子對)平均分裂成游離基的歷程而進行的反應。通常是輻射、燃燒或由過氧化物和熱分解所引起的變化。...
自由基反應又稱游離基反應,是自由基參與的各種化學反應。自由基電子殼層的外層有一個不成對的電子,對增加第二個電子有很強的親和力,故能起強氧化劑的作用。大氣...
岡伯格游離基反應,英文名稱是Gombergfreeradicalreaction,它是指氯化三苯甲烷在惰性溶劑中及在無水氣、空氣、酸、日光存在下,用Zn等金屬處理,生成“六苯基乙烷”的...
【游離基反應性】(radicalreactivity)游離基與其他原子、分子進行化學反應的能力。游離基的活性與其結構有關。烷基和苯基活潑,可成為游離基聚合的活性中心。帶有共軛...
使烯類單體的自由基聚合反應終止的化學反應,通常由阻聚劑分子與鏈式反應中的自由基反應,形成非自由基物質或不能引發的低活性自由基,從而使聚合過程終止。...
脫羧反應是羧酸失去羧基放出二氧化碳的反應。例如:過氧化二苯甲醯的脫羧反應。過氧化二苯甲醯可由苯甲醯氯與過氧化氫反應製得,常用作游離基反應的引發劑。它的...
自由基,化學上也稱為“游離基”,是指化合物的分子在光熱等外界條件下,共價鍵發生均裂而形成的具有不成對電子的原子或基團。(共價鍵不均勻裂解時,兩原子間的...
自由基,化學上也稱為“游離基”,是指化合物的分子在光熱等外界條件下,共價鍵發生均裂而形成的具有不成對電子的原子或基團。(共價鍵不均勻裂解時,兩原子間的...
親電反應指缺電子(對電子有親和力)的試劑進攻另一化合物電子云密度較高(富電子...由親電試劑進攻所引起的加成反應稱為親電加成反應。在沒有光照和自由基引發的...
自由基聚合(free radical polymerization)為用自由基引發,使鏈增長(鏈生長)自由基不斷增長的聚合反應。又稱游離基聚合。加成聚合反應,絕大多數是由含不飽和雙鍵的...
反應歷程屬於游離基反應,首先形成次溴酸醯基化合物,再分解成游離基。反應式:RCOOAg+Br2→RBr+CO2+AgBr過程如下:1.RCOOH與AgNO3形成RCOOAg,再與溴反應生成RCOOBr...
在有機反應中,根據生成的中間體的不同,將反應分為自由基型反應和離子型反應。通過共價鍵均裂生成自由基中間體的反應.稱為自由基型反應;通過共價鍵異裂生成碳正...
是由兩個有機單位進行某種化學反應而得到一個有機分子的過程,其中包括自由基偶聯反應,過渡金屬催化偶聯反應。狹義的偶聯反應指涉及有機金屬催化劑的碳碳鍵形成反應...
自由基引發劑,簡稱引發劑。指一類容易受熱分解成自由基(即初級自由基)的化合物,可用於引發烯類、雙烯類單體的自由基聚合和共聚合反應,也可用於不飽和聚酯的交聯...
G.E. Keck及其團隊在全合成過程中,遇到了將鹵素置換為烯丙基的問題,他們通過鹵代烴和烯丙基三丁基錫進行自由基反應很好的解決了此難題。此反應在催化量的AIBN...
自由基聚合反應是單體藉助於光、熱、輻射、引發劑的作用,使單體分子活化為活性自由基,再與單體連鎖聚合形成高聚物的化學反應。...
研究自由基(free radical chemistry)的產生、結構及化學反應性能的有機化學分支學科。自由基是一種含不成對電子的化學物種,它可以是原子、分子或基團。...
(化學反應)編輯 鎖定 討論999 RAFT是可逆加成-斷裂鏈轉移聚合(Reversible Addition-Fragmentation Chain Transfer Polymerization)的簡稱,是活性/可控自由基聚合(CRP)的...
