基本介紹
- 中文名:泡佩克斯圖
- 外文名:Application of Pourbaix Map
- 發現:Pourbaix
- 學科:化學
- 套用領域:地質科學、濕法冶金等
- 特點:直觀易懂、概括全貌、使用方便
泡佩克斯,泡佩克斯圖簡介,泡佩克斯圖的性質,Lewis酸鹼的泡佩克斯圖,泡佩克斯圖的套用,判斷氧化還原反應進行的方向和順序,解釋天然水的化學行為,在水溶液中金屬防腐的套用,
泡佩克斯
泡佩克斯(M.Pourbaix)是國際知名的腐蝕和電化學科學家。他在化學熱力學領域的傑出工作為電化學,特別是金屬腐蝕科學奠定了重要的理論基礎。英國劍橋大學U.R.Evans將其發明的電位一PH圖對腐蝕電化學的貢獻與微分方程對數學的貢獻相提並論。
由於他的傑出貢獻,使他獲得了腐蝕科學和電化學方面幾乎所有的重要國際大獎,如OlinPalladium獎、U.R.Evans獎。曾任比利時自由大學教授,IUPAC電化學委員會及國際腐蝕理事會ICCO主席,Electrochemica Acta諮詢委員會會員、Corrosion Science編委等職。1990年,美國腐蝕工程師學會建立了“泡佩克斯獎學金",1996年,國際腐蝕理事會建立了“國際合作泡佩克斯獎”。
泡佩克斯圖簡介
泡佩克斯(Pourbaix)圖其實就是“電位一pH圖”。1938年,Pourbaix首先根據Nernst方程式和物種在水溶液中的性質創製了第一幅電位一pH圖,後用熱力學數據,又結合金屬氧化物和氫氧化物的溶解度即有關反應的平衡常數繪製了90種元素和水構成的電位一pH圖,使之成為了一部大型電位一pH圖圖集。泡佩克斯圖亦叫“物質優勢範圍圖”或“優勢區相圖”。這種圖是電化學熱力學分析的結果,在金屬腐蝕、電化學、無機化學、分析化學、地質科學、濕法冶金等方面都得到了廣泛套用。由於該圖直觀易懂、概括全貌、使用方便,所以深受工程人員的歡迎。
套用泡佩克斯圖可以一目了然地看出在一定pH和E下,某元素不同氧化態在水溶液體系平衡時的穩定區;當不同物質相互反應時也可以反映出平衡條件和發生反應的趨勢。但該圖是以熱力學數據為基礎,沒有涉及反應速率,即動力學問題,而且金屬表面的pH值和溶液內部的pH值也有一定的差別,所以泡佩克斯圖僅是一種近似的處理。所以套用泡佩克斯圖討論水溶液體系中的一些實際問題時,還必須進一步從動力學去考察,才能得到滿意的結果,以便預測和分析問題。
泡佩克斯圖的性質
在泡佩克斯圖曲線上的每一個點都表示電極反應在一定條件下(濃度、酸度)達到平衡時,電位與pH之間的關係,所以也稱為“優勢區相圖”。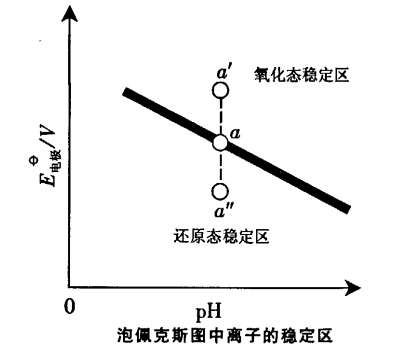 圖1
圖1
 圖1
圖1如圖1所示,當物種離子濃度改變,“氧化態”、“還原態”的濃度就要改變。電位隨著改變,新的平衡點就要移動(或上或下),造成了直線上方為氧化態的穩定區、下方為還原態的穩定區。
Lewis酸鹼的泡佩克斯圖
泡佩克斯圖不僅可用來討論電對的氧化還原性與Bmsted酸性之間的關係,而且對Lewis酸鹼之間的氧化還原化學反應也具有重要的指導意義。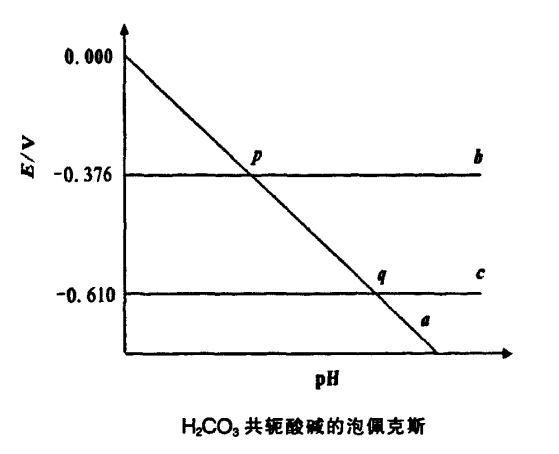 圖2
圖2
 圖2
圖2Lewis酸是指能接受電子對的分子、離子或原子團,Lewis鹼是指能給出電子對的分子、離子或原子團。Lewis酸鹼之間的反應包括了除普通氧化還原反應以外的所有反應。廣義氧化還原反應是指在反應中電子波函式發生了改變的反應,也就是在反應中核外鄰近區內價電子出現機率發生了改變的反應。Lewis酸鹼反應既然是電子對給出和接受的反應,那么價電子在核外的機率分布必然發生改變,因此Lewis酸鹼反應也是廣義氧化還原反應。
龔兆勝等人認為,任何溶液中的Lewis酸鹼反應都是廣義氧化還原反應。只要是溶液中有酸鹼參加的廣義氧化還原反應,都可以得出Lewis酸鹼的電勢一pH圖。
以H2CO3為例制出其泡佩克斯圖(圖2),可直觀地獲得H2CO3和HCO3-不發生離解的條件。H2CO3和HCO3-的氧化還原性的強弱,HCO3-和CO32-的水解方向等信息。
泡佩克斯圖的套用
判斷氧化還原反應進行的方向和順序
用泡佩克斯圖判斷氧化還原反應進行的方向和順序,與用表列標準電極電位判斷的原理和方法相同,但前者直觀、全面因為它可以直接判斷不同濃度和酸度條件下反應進行的方向和順序加圖3所示。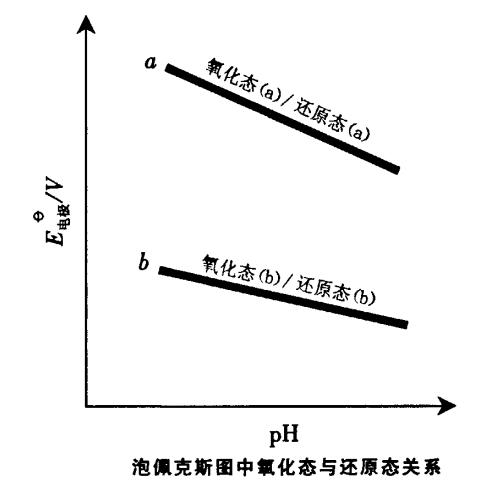 圖3
圖3
 圖3
圖3(1)同一pH值時,位於上面直線的氧化態可與下面直線的還原態物種起反應,也有表列之“對角線規律” ;
(2)直線之間的距離就是兩個電極組成的電池的電動勢,兩條直線之間的距離越大坷越大,△G越負,則反應自發進行的趨勢越大;
(3)對同時存在的幾個反應,氧化還原反應進行的順序可按直線之間距離的大小排列。
解釋天然水的化學行為
水與空氣接觸時被O2飽和,其中許多物種都可被這種強氧化劑所氧化。缺氧條件下(特別是作為還原劑的有機物存在時)可發現更多的還原性物種。控制天然水pH,其主要體系是CO2—H2CO3一HCO3-—CO32-雙質子體系,酸和鹼分別來源於大氣中CO2和溶解的碳酸鹽。生物過程也十分重要:呼吸作用消耗O2並放出CO2這個酸性氧化物使pH下降從而還原電位更負;相反的過程(光合作用)消耗CO2並放出O2,酸的消耗使pH上升從而使還原電位負值減小。圖4給出了有代表性的天然水的pH值和存在與水中的氧化還原電對的電位。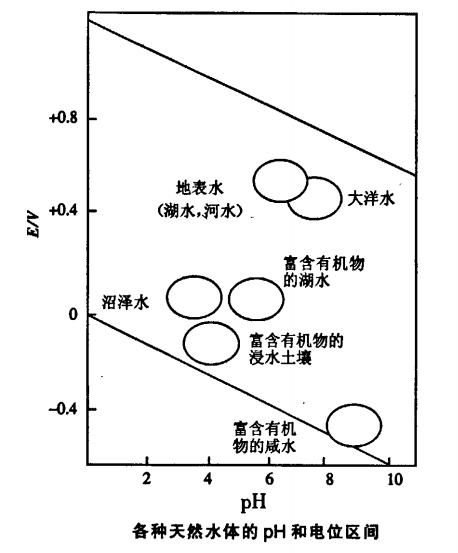 圖4
圖4
 圖4
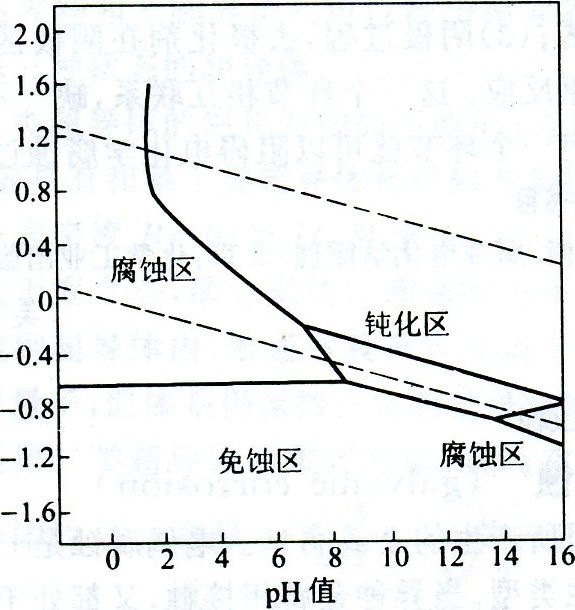
圖4在有色重金屬冶煉過程中,例如在濕法冶金中的浸出、淨化、電解。火法冶金中的洗滌蒸餾冷凝爐氣等操作。往往產生含有一系列重金屬離子的廢水。廢水中特別是Cu2+、Cd2+、Pb2+、Hg2+、As3+等都是有毒的,直接排放到大河、田野將給水體和農田造成嚴重污染。因此廢水在排放前都得進行深度淨化,使重金屬離子的含量達到允許濃度以下。而在污水處理中,金屬一水泡佩克斯圖有著重要意義。
在水溶液中金屬防腐的套用
(1)電化學腐蝕
當金屬中含有比它不活潑的雜質,並與電解質溶液(在潮濕空氣中,金屬表面吸附一層水膜,其中溶有O2、CO2等,起著電解質溶液的作用)接觸時,就形成了原電池,這時活潑金屬為負極(即陽極),雜質為正極(即陰極),因此活潑金屬遭受腐蝕.由於電化學作用引起的腐蝕稱為電化學腐蝕。例如,鋼鐵中含石墨、Fe,C等不活潑雜質,在潮濕空氣中,就在鋼鐵表面形成無數微電池.此時,Fe為陽極,不活潑雜質為陰極,因此,鋼鐵遭受腐蝕。
(2)金屬的防腐
金屬防腐的方法很多。有對金屬進行塗、襯、滲、鍍,或改變金屬的組成以及處理周圍的介質進行電化學保護等。若從泡佩克斯圖來看,可以採取三種方法:
1)把金屬的E降低到平衡線以下落入非腐蝕區此時。處於熱力學穩定態可以免受腐蝕.一般採用陰極保護法,將進金屬與電源負極相連或在金屬片上聯接一種E比該金屬更負更活潑的金屬,使該金屬成為陰極而不遭受腐蝕。
2)把金屬的E升高而進入鈍化區,由於金屬表面生成了難溶的、緻密的保護膜,也可使金屬的腐蝕大大減輕。通常採用陽極保護法,將該金屬與電源正極相連,或在溶液中加入陽極緩蝕劑,或用氧化劑使金屬金屬表面產生鈍化膜。
3)使溶液的pH適當升高,也可以在表面形成鈍化膜。大約在pH=9.0—13.0的範圍內可以生成氫氧化物的鈍化膜。因此,防止金屬在工業用水中的腐蝕,常常加入少量鹼。使水的pH=9.0—13.0之間(因為,pH>14有些金屬可能轉化為含氧酸鹽而溶解,所以,金屬在強鹼性溶液中又將遭受腐蝕,稱為金屬的苛性脆裂),以減輕金屬的腐蝕。