主要類型
自然界中
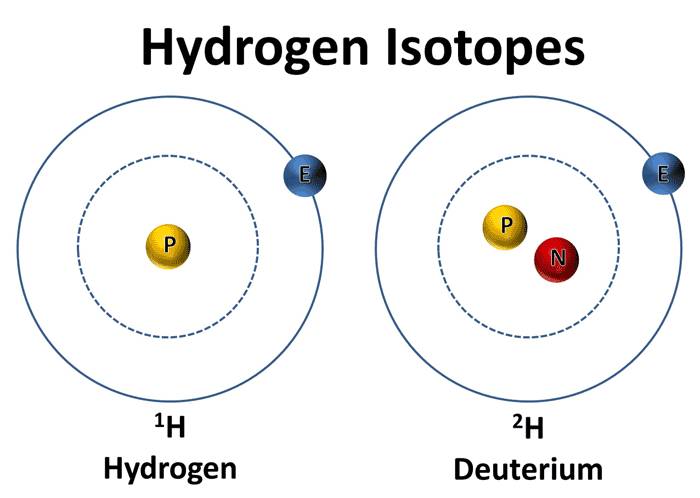
氫以1H(
氕,H),2H(
氘,D),3H(
氚,T)三種
同位素的形式存在,
相對豐度分別為約99.985%、約0.015%、低於0.001%,其中氚具
放射性,
半衰期為12.33年。
套用
液氫精餾、
水電解或
重水分解均可大規模製氘。液氖吸收法制氘的成本可與液氫精餾法相比。吸附分離與
色譜分離是小規模製氘的好方法。利用像熱擴散塔中實行
自然對流的
電泳法,設備簡單、能耗小,預計可以以硫化氫雙溫交換過程(GS過程)競爭。雷射分離氫
同位素是很有希望的方法。採用氟化氘-水雷射分離體系,投資比GS過程節約80%~90%,操作費用節約5/6,已接近實現工業生產水平。
主要特點
氕〈piē〉:原子質量為1的普通的輕氫同位素。
氫的同位素之一,符號H。
質量數1。它是氫的主要成分。
氕(1H)通常稱為
氫,它是氫的主要
穩定同位素,其天然
豐度為99.985%,按原子百分數計,它是宇宙中最多的元素,在地球上的含量僅次於氧,它主要分布於
水及各種
碳氫化合物中,在空氣中的含量僅為5X10 -5%。氕的原子序數為1,原子量為1.007947。在
常溫下,它是無色無臭的氣體。
氘 <dāo>:
氫的同位素,其原子量為普通輕氫的二倍,少量的存在於天然水中,用於
核反應,並在化學和生物學的研究工作中作
示蹤原子。
氘為
氫的一種穩定形態
同位素,也被稱為
重氫,
元素符號一般為D或2H。質量數2。它的原子核由一顆
質子和一顆
中子組成。在大自然的含量約為一般氫的7000分之一,用於
熱核反應。重氫在常溫常壓下為無色無嗅無毒可燃性氣體,是普通氫的一種穩定同位素。它在通常水的氫中含0.0139%~0.0157%。其化學性質與普通氫完全相同。但因質量大,
反應速度小一些。
氫-4:是
氫的
同位素之一,它包含了
質子和三個
中子。在實驗室里,是用
氘的
原子核來轟炸
氚的原子核,來合成一個氫4的原子核。在這過程中,氚的原子核會從氘的原子核上吸收一個中子。氫4的質量為4.0279121U,
半衰期為9.93696x10
-23秒。
氫-4.1:結構上類似
氦,它包含了1個
質子和2個
中子,但因其中一個電子被
渺子。由於渺子的軌道特殊,軌道非常接近
原子核,而最內側的電子軌道與渺子的軌道相較之下在很外側,因此,該渺子可視為原子核的一部分。所以整個原子可視為:“原子核由1個渺子、1個質子和2箇中子組成、外側只有一個電子”。因此可以視為一種
氫的同位素,也是一種
奇異原子。一個渺子重約0.1U,故名氫- 4.1(H)。氫-4.1原子可以與其他元素反應,和行為更像一個氫原子不是像惰性的氦
原子。
氫-5:是氫的
同位素之一,它的
原子核包含了四個
中子和一個
質子,在實驗室里用一個
氚的原子核來轟炸氚,這讓氚吸收兩個氚原子核的質子而形成了氫5。氫5的
半衰期非常短,只有8.01930×10秒。
氫-7:不穩定的氫同位素之一,它包含了一個
質子和六個
中子。
相關圖表
符號
| Z(p)
| N(n)
| | | | | 豐度的變化率
|
1H
| 1
| 0
| 1.00782503207(10)
| 穩定 [>2.8×1023 年]
| 1/2+
| 0.999885(70)
| 0.999816-0.999974
|
2H
| 1
| 1
| 2.0141017778(4)
| 穩定
| 1+
| 0.000115(70)
| 0.000026-0.000184
|
3H
| 1
| 2
| 3.0160492777(25)
| 12.32(2) 年
| 1/2+
| 痕量 | |
4H
| 1
| 3
| 4.02781(11)
| 1.39(10)×10-22 s [4.6(9) MeV]
| 2-
| | |
4.1H | | 2 | 4.11603(2181)# | >2×10-6 s? | 0+# | | |
5H
| 1
| 4
| 5.03531(11)
| >9.1×10-22 s ?
| (1/2+)
| | |
6H
| 1
| 5
| 6.04494(28)
| 2.90(70)×10-22 s [1.6(4) MeV]
| 2-#
| | |
7H
| 1
| 6
| 7.05275(108)#
| 2.3(6)×10-23# s [20(5)# MeV]
| 1/2+#
| | |
備註:畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
氫同位素分離
氫同位素分離是氚的燃料循環中不可缺少的重要單元。依據氫同位素物理或化學性質的微小差異,已發展了低溫精餾、色譜、熱擴散等不同的處理工藝。根據氫同位素的六種分子(H2、HD、HT、D2、DT、T2)沸點存在微小差異的特性,可以選擇低溫精餾工藝進行分離。低溫精餾工藝具有處理量大、分離因子高、連續操作的獨特優勢,在國外已經廣泛套用於重水生產、CANDU堆重水除氚和升級、聚變堆氘氚燃料循等各個領域。低溫精餾工藝的不足之處為一次性投資大,測控和安全要求高,在處理高品位氚時需採取有效措施嚴格控制滯留量。
1、低溫精餾關鍵單元技術
精餾是化工上常見的分離工藝,然而對於氫同位素分離而言,由於其苛刻的低溫分離條件,在工程上必須突破氣體純化、製冷與真空、測量與控制、安全防護、理論設計等幾個方面的關鍵技術。氣體純化進入精餾的原料氣體中往往會含有水汽、氧、氮、
二氧化碳等雜質氣體,在20K的低溫條件下,這些雜質氣體會固化,隨著時間增長慢慢累積,阻塞管道和精餾塔,使閥門和控制設備失靈,嚴重時引發安全事故。因此,必須在原料氣體進入精餾系統前,將其中的雜質氣體去掉,原料氣純化系統是氫低溫精餾裝置系統中不可缺少的重要單元,往往通過乾燥、低溫吸附等工藝級聯的方法將雜質氣體濃度控制在10以下。
2、製冷與真空
精餾過程所需要的低溫環境,是由製冷與真空系統提供的。商業化的大型低溫制冷機能夠長期連續運轉,可靠性非常高,已得到廣泛的套用。如林德公司和法液空都生產各種型號的氦制冷機,製冷量可根據需要調節,可以在不同溫度級上輸出冷量,可以用液氮預冷也可以無需液氮預冷。
3、測量與控制
精餾塔內的溫度、壓力、液位等操作參數的監測和控制是精餾過程能夠順利進行的必要條件,同時,為了獲得好的分離效果,通常會選擇不同的回流比進行操作,這些都需要測控系統配合完成。由於各種氫同位素的沸點僅有微小差異,溫度控制精度要求±0.1K。
精餾塔壓力一般選擇常壓操作,控制精度±100Pa。
4、安全防護
安全也是低溫精餾氫同位素分離面臨的一個重要問題。氫本身為易燃易爆氣體,在空氣中爆炸極限濃度為4%,因此系統必須保證密封良好無泄漏;對於含氚體系的分離,除了防爆檢測以外,還要有嚴格的放射性監測、防護措施。此外,如果因外界停電引起製冷系統停機,液氫失去低溫環境汽化,這會產生極大的壓力毀壞系統甚至引起爆炸。通常設計專門的貯氣罐,用於制冷機發生故障時貯存液氫汽化出來的氫同位素氣體。在低溫條件下,也要確保閥門、泵等的正常工作。因此,上述問題除了在系統設計階段採取周密的技術方案外,還要建立完善的操作規程,對操作人員進行系統的安全教育和培訓,並制定切實可行的應急預案。
5、理論設計
氫同位素分離過程的影響因素是非常多的,總理論板數、回流比、進料位置、操作壓力等都會對分離效果產生影響。此外,在工程套用中,氫同位素涉及的體系往往很多,需要通過多柱級聯的手段才能進行分離,為了降低系統滯留量和增強分離能力,通常還需要加入側線歧化器。理論計算的目的在於揭示影響分離性能的各種因素,揭示分離過程各種組分濃度以及
溫度等參量的變化規律性,為精餾柱設計和系統操作運行提供理論指導。因此,理論模擬作為認識和洞察分離過程規律的重要手段受到了重視。
6、化學平衡器
在氫同位素的六種分子中,HD、HT、DT的分離必須加入化學平衡器,在鉑或鈀的催化作用下發生歧化反應,返回精餾柱進一步分離。歧化反應會對精餾柱上的各種操作參數產生影響,只有在對產品純度要求嚴格的情況下採用。
參看