基本介紹
- 中文名:氧氮環丙烷
- 英文名:Oxaziridine
- 別稱:氮氧雜環丙烷
- 分子量:45
歷史,合成,轉移試劑,氧化雜環丙烷,氧氮雜環丙烷的反應,氧轉移,重排,
歷史
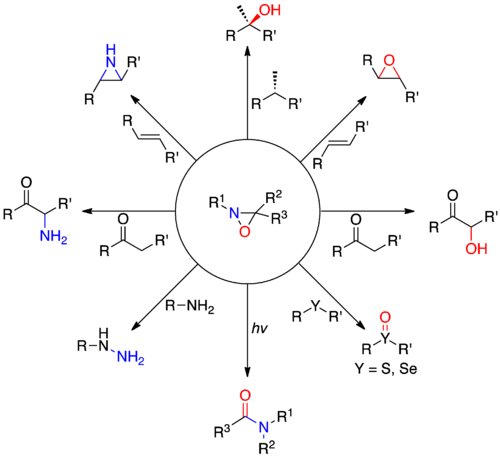
氧氮雜環丙烷在世紀50年代中期被埃蒙斯(Emmons)合成 ,隨後Keimm和霍納和尤爾根。由於高的電負度,氧氣和氮氣通常作為親核試劑,氧氮雜環丙烷允許雜原子的進行親電子轉移。這種不常見的反應是由於高張力的三元環和相對較弱的NO鍵之間的關係。當氮的取代基上是較小的原子時,親核試劑傾向於攻擊aziridine nitrogen上面的的氮原子(R 1 = H),當氮原子上是具有位阻效應的原子取代時,則會攻擊氧原子。氧氮雜環丙烷這種特別的電子轉移方式,可以利用在一些氧和氮的轉移反應,包括α-羥基化反應的烯醇化物,烯烴環氧化,硫化物和硒化物的選擇性氧化,胺化,親核試劑,(醯胺化反應)N-acylamidation…等。 掌性氧氮雜環丙烷試劑已經開發出來,可以允許的雜原子的立體特異性轉移。掌性氧氮雜環丙烷化合物衍生來自氧氮雜環丙烷結構上的取代基或構型固定的氮原子上。氧氮雜環丙烷對於氮原子有著極高反向障礙以保持立體化學結構。Camphorsulfonyloxaziridines在1970s由FA戴維斯合成出來,為不對稱合成殿下了基石。也有許多的有名的合成製造出氧氮雜環丙烷,霍爾頓紫杉醇合成和文德紫杉醇的合成在不對稱α-羥基化反應在Camphorsulfonyloxaziridineszau是一個關鍵的步驟,而紫杉醇是一個複雜的天然產物可以作為化療藥物。
合成
N-H,N-烷基,N-Aryloxaziridines
NH,N-烷基,和N-Aryloxaziridines的合成的兩種主要方法是亞胺和過酸的(A)圖或亞胺和氨化的羰基化合物的(B)氧化作用。

除此之外,亞胺和掌性亞胺的氧化物會生成對稱性的氧氮雜環丙烷,一些氧氮雜環丙烷在室溫下,因為有24 to 31 kcal/mol反相障礙力,可以穩定氮原子的結構特性,研究結果顯示,對稱體氧氮雜環丙烷的立體結構是由型態穩定的氮氣分子導致的。
轉移試劑
在70年代末和80年代初F. A. Davis首次合成的N-Sulfonyloxaziridines,用於氧氮雜環丙烷中作為氧轉移試劑。 原先是mCPBA和相轉移催化劑芐基三甲基氯化銨(benzyltrimethylammonium chloride),經過修改後現在最常使用過一硫酸氫鉀作為氧化劑。
在下表中有這些試劑的性質和反應性。
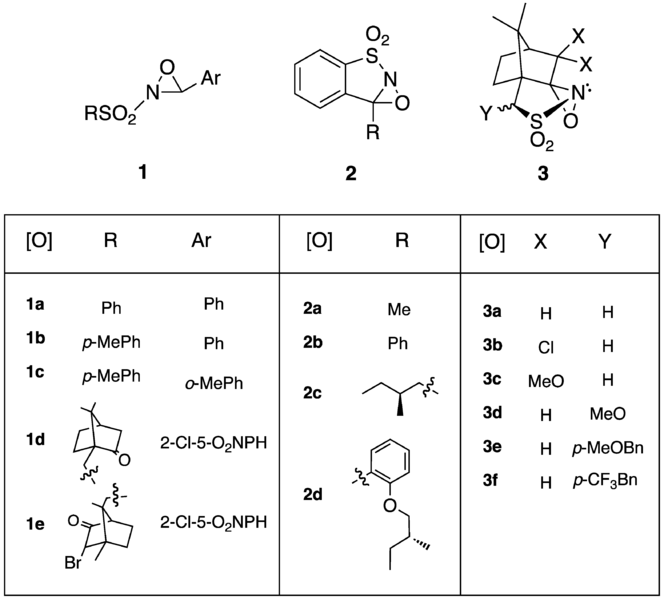
氧化雜環丙烷
全氟取代氧化雜環丙烷展現著一個獨特有趣的反應性在烴類氧的化雜環丙烷中。有者高度的電子withdrawing全氟烷基取代氧化雜環丙烷而合成,而這種合成的反應性跟雙環氧乙烷很像而且比原本的氧化雜環丙烷反應性更好。 值得注意的是,perfluoroalkyloxaziridines對羥化某些特定CH鍵有著高選擇性。全氟取代氧化雜環丙晚可以由全氟亞胺轉移到全氟甲基氟化碳基過氧化物和氟金屬來作為氫氟酸的清潔劑。
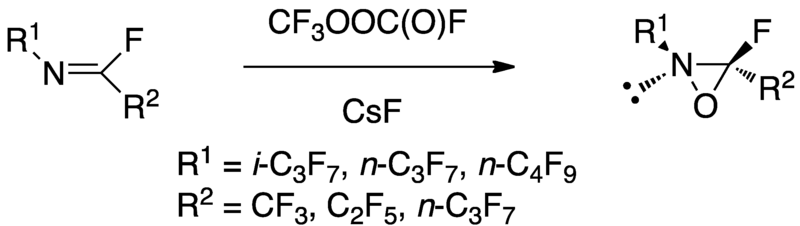
氧氮雜環丙烷的反應
氧轉移
α-羥基化烯醇
α-羥基或醯偶姻都是合成天然產物的重要分子,合成α-羥基酮的的方法有很多種,包括還原α-二酮的烯醇化物、取代羥基作為離去基團並且直接氧化烯醇基。氧代二過氧鉬(吡啶) - (六甲基磷醯三胺)(MoOPH)和N-sulfonyloxaziridines是在這個反應中是最常見的親電子的氧。使用N-sulfonyloxaziridines的優點是在高掌性誘導的過程中,較MoOPH和其他氧化劑更容易觀察的到。 而高產量的產物(77-91%)和高比例的DR比(95:5 - 99:1)證實α-羥基化N-sulfonyloxaziridine是親電子性。

戴維斯研究對非對稱羥化的非掌性烯醇(有機分子-camphorsulfonyloxaziridin) 利用camphorsulfonyloxaziridine使分子轉變高比例的對稱性分子,一般認為過度態的狀態是由立體結構R1的空間位阻決定。
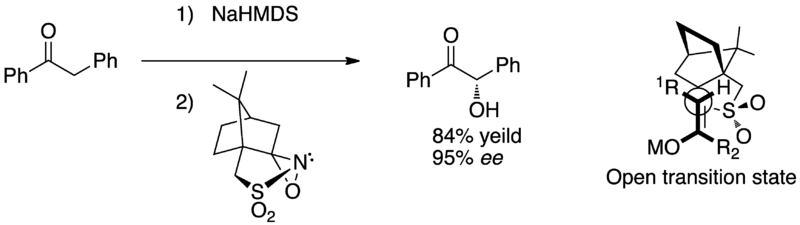
有趣的是,當α-配位基團會與氧氮雜環丙烷環形成氧氮雜環丙烷的狀況下,羥基化的過程會加以改善在表3b.3c在這些例子中,建議是通過closed transition state進行,其中金屬含氧陰離子被硫酸鹽和coordinating groups on the camphor skeleton穩定。

α-羥基和oxaziridines的合成已經被廣泛的使用,而霍爾頓紫杉醇和文德紫杉醇的全合成法Wender Taxol total synthesis是一個關鍵的步驟。此外,福賽斯成功的將C3-C14轉變為岡田酸。

烯烴環氧化(Epoxidation of alkenes)
烯烴的環氧化反應在有機合成中是一種多用途的合成技術。環氧化合物可以產生出一些有用的官能基團。例如與MCPBA或其他過氧酸進行環氧化反應。Oxaziridines可以生成對酸有高敏感性的環氧化物。 進行 (-)-Chaetominine合成時,會利用氧氮雜環丙烷環進行氧化反應,如下圖所示。

使用不對稱環氧化是另一種高產率的合成方法。在文獻裡面有許多種不對稱環氧化,例如sharpless epoxidation the Jacobsen-Katsuki epoxidation and the Juliá-Colonna Epoxidation.這些方法這些方法有一個主要的缺點,為了要有選擇性,要先進行特殊的官能基化。The Sharpless epoxidation是利用對烯丙醇、Jacobsen epoxidation要用順式 - 雙取代的芳基鏈烯,而Juliá epoxidation是要用α-β不飽和酮。不對稱環氧化氧氮雜環丙烷試劑是在有幾個轉換的選擇,利用足夠的非對稱誘導,使沒有官能化的烯烴具有立體特殊性,達到不同的立體空間面相。 此外Lusinichi et al也研究了使用過硫酸氫鉀使掌性過氧亞胺正離子鹽進行不對稱環氧化,在如下圖顯示的過程。

沒反應的碳氫化合物被羥基化
Perfluorinated oxaziridin一般用在水解未反應的碳氫鍵,使其有顯著的區域選擇性和不同的立體分辨力。考慮非金屬的氧化劑的性質,這是一個高度轉換的特性,很少有類似的反應可以有同樣的轉換率。Perfluorinated oxaziridines對於三級氫有著高選擇性。在羥基化的一級碳和二羥基化的化合物有兩個氧化的地方是沒有被發現的。非常高的立體化學構型(95 - 98%)
氮轉移
2000年以來已經相當少將氧氮雜環丙烷用來氮轉移試劑。氧氮雜環丙烷和未取代或醯基化的氮能夠進行此化學反應。奧默和施密茨在1964年錄得氮轉移的第一個實例。
Amination of N-nucleophiles
N-未取代氧氮雜環進行親核試劑的胺化,對親核試劑和相對應的產品來說是很常用的。Hydrazines可以從胺化的2級或3級胺產生,而羥胺和硫羥胺可以被相應的醇和硫醇產生,sulfimides可以從硫醚和α-氨基酮產生也可以由相應的烯醇化物的攻擊產生。
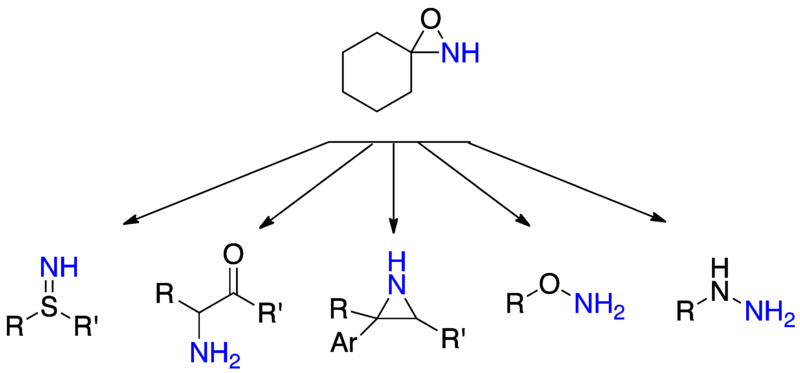
N-acylamidation
要轉移醯基化上的胺比未取代的胺困難,它不像胺是由氧氮雜環丙烷轉移,而且在轉移醯胺這方面,沒還有直接轉移的方法。Acylamine主要是作為轉移親核試劑的胺和hydrazines。目前有少數論文表示,少數的醯基化的氮與碳親核試劑成功的進行。

重排
研究發現當氧氮雜環丙烷用紫外光照射或在單電子轉移之下會透過輻射機制重新排列,例如:cuspirocylic氧氮雜環丙烷進行環擴展到的內醯胺。有趣的是,遷移取代基會受到立體電子效應影響,在氮上的孤對電子常常是最主要遷移的產物。 在光的影響中,可以藉由下列的選擇性重組觀察到,掌性氮會受到反相阻隔並直接重排。 重組的過程中,左邊的熱力學產物是較不容易產生出來的,而較喜愛從不穩定的自由基中間物產生右邊的產物。

AUBE利用這種重組的反應作為在他合成(+)-yohimbine,[25]的關鍵步驟,(+)-yohimbine是一種天然藥物,而NIH歸類為可以治療由選擇性血清素再吸收抑制劑所引起的勃起功能障礙性問題。

還有值得注意的是氧氮雜環丙烷有可能熱重組為硝酮(nitrones),且產量是相當好的,相反的利用順反選擇的nitrons的產物通常很少品質也不好。有些人認為一些氧氮雜環丙烷經過一段時間會轉變為硝酮中間產物。

Cycloaddions with heterocumulenes
氧氮雜環丙烷和heterocumulenes在環加成反應中,加入了獨特的五元雜環化合物如下圖所示。這反應是由於張力3元環和弱NO鍵產生。

