氧平衡是指炸藥爆炸生成碳、氫的氧化物時,以克為單位表示的氧的剩餘量,它表明炸藥實際含氧量與使炸藥中的碳和氫完全氧化所需氧量之間相差程度。氧平衡情況直接影響爆破效果和爆炸後生成多少有毒氣體,最理想的是零氧平衡。
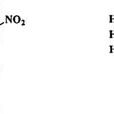
氧平衡
相關詞條
- 氧平衡
氧平衡模式是水質數學模型的一種。用數學式來表達水體中溶解氧時變化的規律,可描述溶解氧的衰變(耗氧)與恢復(復氧)平衡過程的水質模式。...
- 炸藥氧平衡
炸藥氧平衡,是指炸藥中的氧用來完全氧化炸藥本身所含的碳和氫為二氧化碳和水以後多餘或不足的氧量。...
- 氧平衡評價
氧平衡評價是用DO、COD、BOD、TOD、TOC等氧平衡指示對水體的有機污染進行評價。...... 氧平衡評價是用DO、COD、BOD、TOD、TOC等氧平衡指示對水體的有機污染進行...
- 碳—氧平衡
綠色植物在光合作用中製造的氧,超過了自身呼吸作用對氧的需要,其餘的氧都以氣體的形式排到了大氣中;綠色植物還通過光合作用,不斷消耗大氣中的二氧化碳,這樣就維持...
- 氧平衡模式
氧平衡模式是水質數學模型的一種。用數學式來表達水體中溶解氧時變化的規律,可描述溶解氧的衰變(耗氧)與恢復(復氧)平衡過程的水質模式。...
- 炸藥的氧平衡
中文名稱:炸藥的氧平衡 英文名稱:Blasting explosive oxygen balance 定義:炸藥中所含的氧量與可燃元素完全氧化所需氧量的關係。 所屬學科:煤炭科技(一級學科) ;...
- 生化需氧量
生物需氧量(常記為BOD)是指在一定條件下,微生物分解存在於水中的可生化降解有機物所進行的生物化學反應過程中所消耗的溶解氧的數量。以毫克/升或百分率、ppm表示...
- 高氧血
高氧血是一種氧氣濃度較高的一種血液。高氧血的相關資料。...... 本研究通過在大面積燒傷病人早期復甦中靜脈套用高氧平衡鹽溶液,既注意到迅速糾正血容量改善灌注,...
- 工業炸藥配方設計
第一節 工業炸藥的氧平衡一、氧平衡的概念二、氧平衡的計算三、工業炸藥的氧平衡計算第二節 工業炸藥的爆炸反應方程式一、對於只含碳、氫、氧、氮元素的工業炸藥...
- 光合作用(反應)
[1] 其主要包括光反應、暗反應兩個階段, [2] 涉及光吸收、電子傳遞、光合磷酸化、碳同化等重要反應步驟,對實現自然界的能量轉換、維持大氣的碳-氧平衡具有重要...
- 陳新民(中國科學院院士、中南礦冶學院第一任院長)
1945年(中華民國三十四年)6月,通過了博士論文答辯,獲美國麻省理工學院科學博士學位,他撰寫的論文《熔鐵中的鉻—氧平衡》,首次以實驗方法測出,熔鐵內的鉻含量...
- 熱帶雨林生態系統
熱帶雨林是“地球之肺”,在大氣的碳氧平衡中發揮著舉足輕重的作用。近年來溫室效應的加劇也與熱帶雨林生態系統遭到破壞有很大的關係。中文...
