氧化錳(manganese oxide),灰白色到暗綠色無定形粉末,經常出現於軟錳礦及錳結核中。
2012年,國內六大主要港口錳礦庫存減少111萬噸左右,進口錳礦表觀消費量達1349萬噸。從各個海關通關情況來看,錳礦集中程度進一步加劇,據智研諮詢測算,天津港、欽州港錳礦報、通關量達73%,較2011年上升3個百分點,且天津港進口錳礦通關量增加明顯。另外,以目前港口規划進程,13年該種態勢有進一步加強趨勢。
基本介紹
- 中文名:氧化錳
- 外文名:Manganese Oxide
- CAS NO:1344-43-0
- 分子式:MnO
- 晶體結構:岩鹽(Rock Salt),氯化鈉結構
- 固體表征:灰白色到暗綠色粉末
- 水溶性:難溶於水
- 性狀:灰白色到暗綠色無定形粉末
基本信息
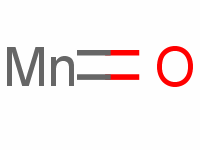
Melting_point 1650℃
相對Density 5.43~5.46
溶解性 不溶於水,溶於酸和氯化銨。

