當一個分子中有兩個環,而且這兩個環共享一個碳原子時,這種體系稱為螺環。更典型的情況是兩個環共享兩個碳原子,這兩個碳原子稱為橋頭碳。這兩個橋頭碳原子之間可以有三種不同路徑,這類橋環體系(或稱雙環體系)就是通過列出這些路徑的長度來命名的。因此,萘烷被命名為橋環[4,4,0]癸烷或雙環[4,4,0]癸烷。
基本介紹
- 中文名:橋環體系
- 外文名:Bridged-ring system
- 代表物質:螺環
- 套用學科:有機化學
- 別稱:雙環體系
- 常見化合物:萜類化合物
橋環體系主橋選原則,橋環體系張力分析,橋環體系化合物,常見合成方法,布萊得規則,
橋環體系主橋選原則
橋環體系中主橋的選擇按下列原則:
①含雜原子;
②含較少的原子;
③飽和的橋;
④取代基較少或取代基按優先規則較小。
下圖中的兩個化合物中,—CH—的主橋和兩個H在環的同一面,或者說不在主橋上的取代基與所參照比較的橋平面(此處為主橋平面)不在同一側的稱為內型(endo-),反之為外型(exo-)。
 內型和外型
內型和外型橋環體系張力分析
對簡單體系來說,橋環體系中的張力就是兩個單環中的張力的簡單加和。比如說橋環[3,1,0]己烷的張力能等於環戊烷(6.2 kcal/mol)和環丙烷(27.5 kcal/mol)的張力能之和(33.7 kcal/mol),而實驗值為33.9 kcal/mol,兩者吻合得相當好。但是對小環而言簡單的加和是有問題的。比如由兩個環丙烷組成的橋環分子的張力能的預測值為2×27.5 kcal/mol=55 kcal/moI。然而螺環[2,2]戊烷和橋環[1,1,0]丁烷的張力能在65~66 kcal/mol這個範圍,要比預測值高10 kcal/mol。在這些體系中環的融合帶來了新的張力,但是這種效應在橋環[2,1,0]戊烷中卻顯著減小。環系越大,簡單加和的辦法就越有效。
有一個的例子就是立方烷,如下圖:
 立方烷張力
立方烷張力它的張力能的預測值為6×26.3 kcal/mol=158 kcal/mol,而實驗值約為166 kcal/mol。只要是不包含環丙烷和環丁烷的多環體系,用分子力學的辦法來處理也是可行的,這就使環張力的分析更加直接。
橋環體系化合物
含有橋式二環體系的脂環族化合物的特點是在它們的環中有三個或者更多的共用碳原子。
 常見化合物
常見化合物這類化合物廣泛地分布在自然界中,萜類化合物是屬於其中的主要形式。
常見合成方法
橋環體系的合成,可以藉助於在單環化合物的衍生物中關閉第二個環的方法而得到實現。這裡提到的是1,3或1,4位置上的基團參與分子內成環作用的方法,例如:
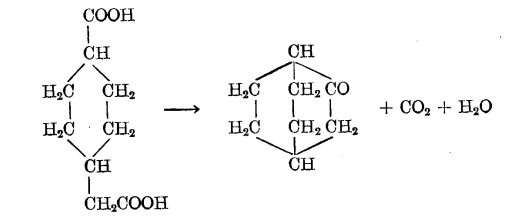 反應方程式
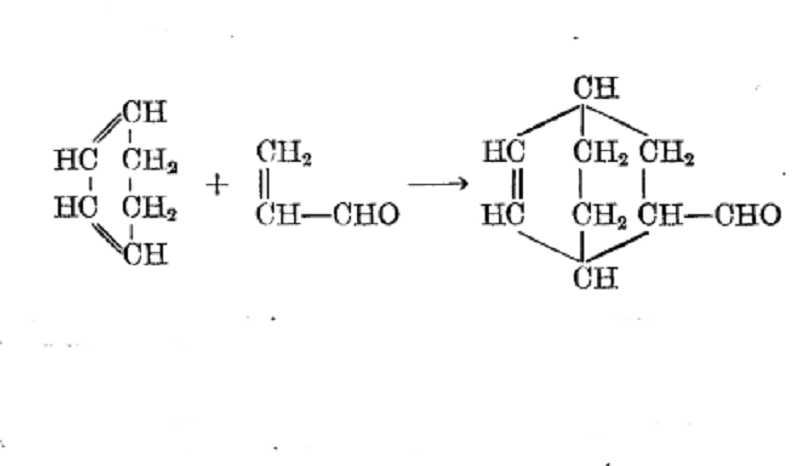
反應方程式但是橋環化合物的最重要合成方法是第爾斯一阿爾得爾合成,例如:
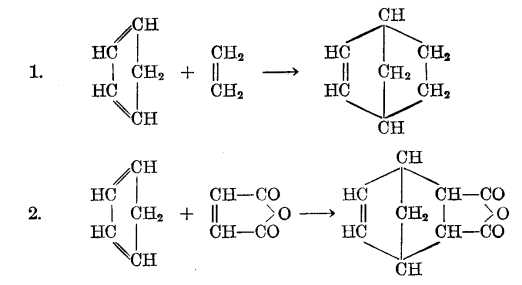 反應方程式
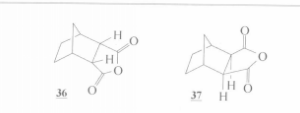
反應方程式由於試劑的相互定向效應,這些反應可以生成兩種類型的加成產物。例如,從環戊二烯和順-丁烯二酸酐可以獲得如下立體異構的酸酐:
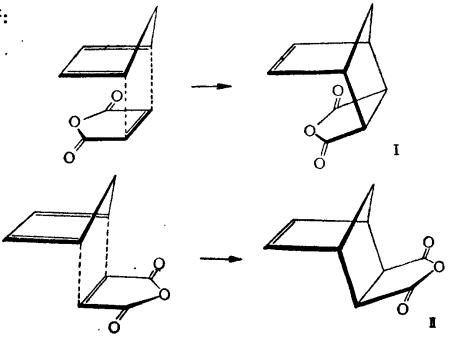 立體異構酸酐
立體異構酸酐在水解作用下,這兩個酸酐即生成相應的酸:
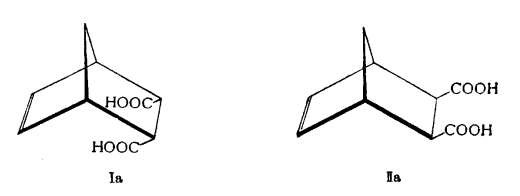 化合物
化合物在一個環上所結合著的取代基,如果與另一個環處在同一邊,則這種構型即被稱為內一型;倘若取代基與另一個環不處在同一邊,則這種立體異構體便稱為外一型。因此,化合物Ⅰ和Ⅰa是內一型的酸酐和酸,而Ⅱ和Ⅱa是共外一型的立體異構體。原來,在不高的溫度下,這個反應是具有立體專一性的(即在反應中,只趨向於形成一種空同異構體),而只產生內一型的化合物。在較高的溫度下,所產生的是這兩個構型的混合物。
布萊得規則
在橋環體系所表現的特性中,應當指出名為布萊得規則規律。根據這個規則,橋環體系的集合原子上不能有雙鍵,也就是說這種類型的化合物,如下圖,是不存在的。
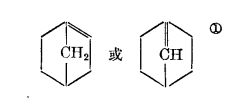 不存在化合物
不存在化合物在橋環體系中倘若包含有這樣的平面基團,必然在分子中引起很大的強力。但從這些見解也可以得出這樣的結論:在很大的環中,這種強力將不表現得如此強烈,以數在這樣的體系中有可能違反布榮得規則。計算算表明,在這樣的橋環體系中,即共中的一個環有不少於五個碳原子構成的鍵與集合原子相結合,布萊得規則即失去其作用。