基本介紹
- 中文名稱:構造原理
- 英文名稱:aufbau principle
- 套用學科:化學(一級學科)
原理簡介
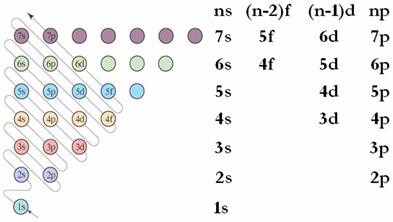

構造原理,是化學中的一種定理,決定了原子、分子和離子中電子在各能級的排布。隨核電荷數遞增,大多數元素的電中性基態原子的電子按順序填入核外電子運動軌道,即為...
《結構原理》是中國建築工業出版社出版的圖書。...... 《結構原理》目的在於給沒有力學基礎的讀者,介紹如何理解建築結構的基本概念和工程的總體概況。全書圖文對照講解...
《結構原理與結構概念設計》可作為土木工程專業、建築學專業、工程管理專業學生在學習專業結構類課程前的選修課教材,也可作為“結構設計競賽”的培訓教材和參考書。...
《結構設計原理》是2009年8月北京理工大學出版社出版的圖書,作者是於輝、崔岩。本書可作為高職高專道路與橋樑技術專業等交通土建類專業教材,亦可供從事公路與橋樑...
建築構造是指建築物各組成部分基於科學原理的材料選用及其做法。其任務是根據建築物的功能、材料性質、受力情況、施工方法和建築形象等要求選擇合理的構造方案,以作為...
地質構造(geological structure) 是指在地球的內、外應力作用下,岩層或岩體發生變形或位移而遺留下來的形態。在層狀岩石分布地區最為顯著。在岩漿岩、變質岩地區也有...
《機電設備原理與構造》是2010年科學出版社出版的圖書,作者是張新民,本書主要介紹了各類工具機的作用、工作原理、典型部件與構造。...
《圖解汽車底盤構造與原理》是2017年電子工業出版社出版的圖書,作者是劉春暉、蘇朝輝。...
丹尼爾·伯努利在1726年提出了“伯努利原理”。這是在流體力學的連續介質理論方程建立之前,水力學所採用的基本原理,其實質是流體的機械能守恆。即:動能+重力勢能+...
《焊接結構原理》是2011年北京航空航天大學出版社出版的圖書,作者是張彥華。...... 《焊接結構原理》是2011年北京航空航天大學出版社出版的圖書,作者是張彥華。...
《材料的晶體結構原理》是2007年冶金工業出版社出版的圖書,作者是毛衛民。...... 《材料的晶體結構原理》是2007年冶金工業出版社出版的圖書,作者是毛衛民。...
填料塔結構原理編輯 鎖定 本詞條缺少信息欄、名片圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!填料塔是以塔內的填料作為氣液兩相間接觸構件的傳質設備...
採用項目導向、任務驅動的方式,將汽車的故障診斷、零部件拆裝、構造原理、日常使用維護與主要檢查調整等內容學習有機融合。以乘用車為主,突出了現代汽車電子控制技術...
《鋼結構原理》為套用型本科院校土木工程專業的專業課教材。全書共分7章,包括:緒論、鋼結構的材料、軸心受力構件、受彎構件(梁)、拉彎構件和壓彎構件、鋼結構的...
《結構設計原理(上)》是1999年中國鐵道出版社出版的圖書,作者是黃棠。...... 《結構設計原理(上)》是1999年中國鐵道出版社出版的圖書,作者是黃棠。...
《新能源汽車構造原理與維修》是2018年化學工業出版社出版的圖書,作者是崔金明、鄭為民。...
《建築結構基本原理》一書的出版社是中國建築工業出版社,作者是宋占海,賈建東,宋東,出版時間是2006-2-1。...
《鋼結構原理與設計》是2010年6月1日重慶大學出版社出版的一本書籍,作者是趙風華、齊永勝。該書主要講述了鋼結構的基本原理和基本構件。全書共分6章,內容包括:...
