怡諾思(鹽酸文拉法辛緩釋膠囊,英文商品名為EFFEXOR XR或EFEXOR XR),是輝瑞公司旗下的抗抑鬱藥之一,是全球第一個上市的5-羥色胺(5-HT)和去甲腎上腺素(NE)再攝取抑制劑(SNRI),俗稱“雙通道抗抑鬱藥”,適用於治療各種類型抑鬱症(包括伴有焦慮的抑鬱症)及廣泛性焦慮症。
EFFEXOR XR上市十幾年來,基於大量臨床研究證據,已被多個國家和地區的醫學指南推薦作為抑鬱症(尤其是伴焦慮的抑鬱症)及廣泛性焦慮障礙的一線治療藥物(如美國、加拿大、歐洲、中國等)。
基本介紹
- 是否處方藥:處方藥
- 藥品名稱:怡諾思
- 藥品類型:醫保工傷用藥
- 用途分類:其他抗抑鬱藥
警示語,成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,研發歷程,貯藏,包裝,有效期,執行標準,批准文號,生產企業,包裝企業,核准日期,修訂日期,
警示語
自殺傾向和抗抑鬱藥物
對抑鬱症(MDD)和其它精神障礙的短期臨床試驗結果顯示,與安慰劑相比,抗抑鬱藥物增加了兒童、青少年和青年([24 歲)患者自殺的想法和實施自殺行為(自殺傾向)的風險。任何人如果考慮將怡諾思®緩釋膠囊或其它抗抑鬱藥物用於兒童、青少年或青年([24 歲),都必須在其風險和臨床需求之間進行權衡。短期的臨床試驗沒有顯示出,與安慰劑相比年齡大於24 歲的成年人使用抗抑鬱藥物會增加自殺傾向的風險;而在年齡65 歲及以上的成年人中,使用抗抑鬱藥物後,自殺傾向的風險有所降低。抑鬱和某些精神障礙本身與自殺風險的增加有關,必須密切觀察所有年齡患者使用抗抑鬱藥物治療開始後的臨床症狀的惡化、自殺傾向、行為的異常變化。應建議家屬和看護者必須密切觀察並與醫生進行溝通。怡諾思®緩釋膠囊未被批准用於兒童患者(見[注意事項]-警告,臨床症狀的惡化和自殺風險,[注意事項]-患者用藥信息,和[兒童用藥])。
對抑鬱症(MDD)和其它精神障礙的短期臨床試驗結果顯示,與安慰劑相比,抗抑鬱藥物增加了兒童、青少年和青年([24 歲)患者自殺的想法和實施自殺行為(自殺傾向)的風險。任何人如果考慮將怡諾思®緩釋膠囊或其它抗抑鬱藥物用於兒童、青少年或青年([24 歲),都必須在其風險和臨床需求之間進行權衡。短期的臨床試驗沒有顯示出,與安慰劑相比年齡大於24 歲的成年人使用抗抑鬱藥物會增加自殺傾向的風險;而在年齡65 歲及以上的成年人中,使用抗抑鬱藥物後,自殺傾向的風險有所降低。抑鬱和某些精神障礙本身與自殺風險的增加有關,必須密切觀察所有年齡患者使用抗抑鬱藥物治療開始後的臨床症狀的惡化、自殺傾向、行為的異常變化。應建議家屬和看護者必須密切觀察並與醫生進行溝通。怡諾思®緩釋膠囊未被批准用於兒童患者(見[注意事項]-警告,臨床症狀的惡化和自殺風險,[注意事項]-患者用藥信息,和[兒童用藥])。
成份
本品主要成分及其化學名稱為:
本品主要成分為鹽酸文拉法辛, 化學名稱為:(R/S)-1-[2-(二甲胺)-1-(4-甲氧苯基)乙基]環己醇鹽酸鹽或 (+)-1-[a-[(二甲胺)甲基]-p-甲氧苯甲基]環己醇鹽酸鹽。
其結構式為:
分子式:C17H27NO2·HCl
分子量:313.87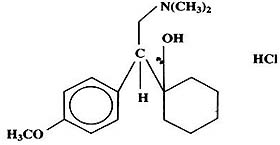
本品主要成分為鹽酸文拉法辛, 化學名稱為:(R/S)-1-[2-(二甲胺)-1-(4-甲氧苯基)乙基]環己醇鹽酸鹽或 (+)-1-[a-[(二甲胺)甲基]-p-甲氧苯甲基]環己醇鹽酸鹽。
其結構式為:
分子式:C17H27NO2·HCl
分子量:313.87

性狀
本品為硬膠囊,內含白色到類白色球形小丸
怡諾思[sup]®[/sup]緩釋膠囊75mg為不透明桃色膠囊,囊帽上印有紅色“W”,囊體上印有紅色“75”
怡諾思[sup]®[/sup]緩釋膠囊150mg為不透明深桔色膠囊,囊帽上印有白色“W ”,囊體上印有白色“150”
怡諾思[sup]®[/sup]緩釋膠囊75mg為不透明桃色膠囊,囊帽上印有紅色“W”,囊體上印有紅色“75”
怡諾思[sup]®[/sup]緩釋膠囊150mg為不透明深桔色膠囊,囊帽上印有白色“W ”,囊體上印有白色“150”
適應症
本品適用於治療各種類型抑鬱症(包括伴有焦慮的抑鬱症)及廣泛性焦慮症。
各種類型抑鬱症
怡諾思®緩釋膠囊(鹽酸文拉法辛)推薦用於治療各種類型抑鬱症。
怡諾思®緩釋膠囊治療符合診斷與統計手冊第三版(修訂版)(DSM-III-R)或診斷與統計手冊第四版(DSM-IV)診斷標準的門診成年抑鬱症患者的療效已在8周和12周的對照研究中得到確定(見[臨床試驗])。
一次抑鬱發作(DSM-IV)是指明顯和相對持久(在2周時間內的幾乎每一天)的抑鬱情緒伴有對幾乎所有活動興趣減退和愉快感的缺失,與其平時的表現明顯不同,同時在2周的時間內具有以下9項症狀中的5項:抑鬱情緒、日常活動中的明顯興趣減退和愉快感缺失、體重和食慾的明顯變化、失眠或睡眠過多、精神運動性激越或遲滯、疲勞、自責自罪或無價值感、思維遲緩和注意力難以集中以及自殺意念和自殺行為。
廣泛性焦慮症(GAD)
怡諾思®緩釋膠囊推薦用於治療廣泛性焦慮症患者。日常應激相關的焦慮和神經質一般不需要套用抗焦慮藥。
在為期8周和6個月的安慰劑對照研究證實怡諾思®緩釋膠囊對符合DSM-IV診斷標準的GAD患者有效(見[臨床試驗])。
廣泛性焦慮症(DSM-IV)是指維持至少6個月難以控制的過分焦慮和擔心(預期)。
至少具有以下6項症狀中的3項:坐立不安和神經質、容易疲勞、難以集中注意力或頭腦空白、易怒、肌肉震顫和睡眠障礙。
儘管為期6 個月的臨床研究證實怡諾思®緩釋膠囊對廣泛性焦慮症患者有效,但當醫生選擇怡諾思®緩釋膠囊作為長期治療時應該定期評估藥物對患者的長期療效(見[用法用量])
各種類型抑鬱症
怡諾思®緩釋膠囊(鹽酸文拉法辛)推薦用於治療各種類型抑鬱症。
怡諾思®緩釋膠囊治療符合診斷與統計手冊第三版(修訂版)(DSM-III-R)或診斷與統計手冊第四版(DSM-IV)診斷標準的門診成年抑鬱症患者的療效已在8周和12周的對照研究中得到確定(見[臨床試驗])。
一次抑鬱發作(DSM-IV)是指明顯和相對持久(在2周時間內的幾乎每一天)的抑鬱情緒伴有對幾乎所有活動興趣減退和愉快感的缺失,與其平時的表現明顯不同,同時在2周的時間內具有以下9項症狀中的5項:抑鬱情緒、日常活動中的明顯興趣減退和愉快感缺失、體重和食慾的明顯變化、失眠或睡眠過多、精神運動性激越或遲滯、疲勞、自責自罪或無價值感、思維遲緩和注意力難以集中以及自殺意念和自殺行為。
廣泛性焦慮症(GAD)
怡諾思®緩釋膠囊推薦用於治療廣泛性焦慮症患者。日常應激相關的焦慮和神經質一般不需要套用抗焦慮藥。
在為期8周和6個月的安慰劑對照研究證實怡諾思®緩釋膠囊對符合DSM-IV診斷標準的GAD患者有效(見[臨床試驗])。
廣泛性焦慮症(DSM-IV)是指維持至少6個月難以控制的過分焦慮和擔心(預期)。
至少具有以下6項症狀中的3項:坐立不安和神經質、容易疲勞、難以集中注意力或頭腦空白、易怒、肌肉震顫和睡眠障礙。
儘管為期6 個月的臨床研究證實怡諾思®緩釋膠囊對廣泛性焦慮症患者有效,但當醫生選擇怡諾思®緩釋膠囊作為長期治療時應該定期評估藥物對患者的長期療效(見[用法用量])
規格
75mg/粒
150mg/粒
用法用量
怡諾思®緩釋膠囊應該在早晨或晚間一個相對固定時間和食物同時服用,每日一次。膠囊應該整體服下避免分開、壓碎、咀嚼或溶解後服用,也可以仔細打開膠囊將內容物放於一勺蘋果沙司中,這個藥物/食物的混合物應不嚼很快咽下,接著喝一杯水保證完全服下。
初始治療
各種類型抑鬱症
對於多數患者,推薦怡諾思®緩釋膠囊的起始劑量為每天75毫克,單次服藥。在怡諾思®緩釋膠囊治療門診中度抑鬱症患者的臨床研究中,起始劑量為每天75毫克。對某些新發病患者,在調整劑量增至每日75毫克前,可能更適於每日37.5毫克起始治療4至7天。雖然劑量和抗抑鬱作用的關係未能充分探討,但一些患者對每天75毫克的劑量無效時可能在劑量提高到最大約每天225毫克有效,因為在大部分患者文拉法辛和主要代謝產物到第4天達到穩態濃度,如果必要可以在4天以上的間隔,以增量可達75毫克/日的幅度加量。在評估療效的研究中,允許在2周以上的間隔進行藥物的滴定,平均劑量約為每天140~180毫克(見[臨床試驗])。
尚不知對較嚴重的抑鬱症患者是否應使用高於每天225毫克劑量的怡諾思®緩釋膠囊,目前尚缺乏怡諾思®緩釋膠囊劑量高於每天225毫克的經驗(見[注意事項] -用於有伴發疾病的患者)。
廣泛性焦慮症
對於多數患者,推薦怡諾思®緩釋膠囊的起始劑量為每天75毫克,單次服藥。在怡諾思®緩釋膠囊治療門診廣泛性焦慮症療效的臨床研究中,起始劑量為每天75毫克最大劑量為每天225毫克。對某些新發病患者,在調整劑量增至每日75毫克前,可能更適於每日37.5毫克起始治療4至7天。雖然在固定劑量的研究中未能明確證實治療GAD的量效關係,但一些患者對每天75毫克的劑量無效時可能在劑量提高到約每天225毫克有效,如果必要可以在4天以上的間隔,以增量可達75毫克/日的幅度加量(見[注意事項] -用於有伴發疾病的患者)。
從鹽酸文拉法辛常釋片換用緩釋膠囊
當前套用鹽酸文拉法辛常釋片治療的抑鬱症患者可以換用每日治療劑量幾乎等同的緩釋膠囊,如服用37.5mg文拉法辛每日兩次,可換用75mg的緩釋膠囊,每日一次。必要時需要根據患者的個體情況進行調整。
特殊人群
對孕期後3個月的孕婦的治療
在第7孕月以後暴露於怡諾思®緩釋膠囊、其它5-羥色胺和去甲腎上腺素再攝取抑制劑(SNRIs)和選擇性5-羥色胺再攝取抑制劑(SSRIs)的新生兒,其需要呼吸支持、胃管餵養和延長住院等併發症的發生率增加(見[孕婦及哺乳期婦女用藥])。在孕期的後3個月使用怡諾思®緩釋膠囊時醫生應仔細權衡利弊,需要考慮減量。
肝功能不全患者
肝硬化和輕至中度肝功能不全的患者與健康者相比,文拉法辛和O-去甲基文拉法辛(ODV)的清除半衰期延長、清除率下降(見[藥代動力學]),對於輕度至中度肝功能不全的患者每日總劑量必須減少50%。對於有些患者,甚至有必要將劑量減少50%以上。因為肝硬化患者的藥物清除率有較大個體差異,個體化用藥較合適。
腎功能不全患者
腎功能不全患者(GFR=10~70 mL/min)與健康者相比,文拉法辛的清除率下降、文拉法辛和ODV的清除半衰期延長(見[藥代動力學]),每日總劑量必須減少25%~50%。接受透析治療的患者,每日總劑量必須減少50%。因為腎功能不全患者的藥物清除率有較大個體差異,對於某些患者應當個體化用藥。
兒童
尚無 18 歲以下患者適用本品的安全性和有效性的數據。
老年患者
老年患者無需因為年齡調整劑量。然而如同用於抑鬱症和GAD的其它藥物,老年患者用藥應謹慎,劑量應個體化,如果需要增加劑量,應仔細監測患者情況。
維持治療
尚無來自於對照研究肯定的依據表明怡諾思®緩釋膠囊治療抑鬱症和GAD時需要治療多長時間。一般認為在治療抑鬱症的急性症狀有效後,需要藥物鞏固治療數月或更長時間。在1項研究中,怡諾思®緩釋膠囊治療8周有效的患者,隨機分為安慰劑治療組、與先前治療劑量相同的怡諾思®緩釋膠囊(每天上午75、150或225 毫克)治療組,維持治療26周證實了怡諾思®緩釋膠囊的長期療效。
根據這些有限的資料,還不知道怡諾思®緩釋膠囊維持治療的劑量是否應等於初始治療的有效劑量。治療中應定期重新評估維持治療的必要性和合適的劑量。
怡諾思®緩釋膠囊在為期6個月的臨床研究中顯示對於GAD患者的治療有效。對於怡諾思®緩釋膠囊治療有效的GAD患者繼續用藥的必要性應該定期重新評估。
停用怡諾思®緩釋膠囊
和怡諾思®緩釋膠囊、其它SNRIs和SSRIs停藥相關的症狀已有報告(見[注意事項])。當患者停藥時應注意監測這些症狀,儘可能推薦逐漸減量而不是突然停藥。如果使用文拉法辛超過6周,建議逐漸減量時間最少要多於兩周。如果在減藥或停藥過程中出現不能耐受的反應,可以考慮恢復至先前的處方劑量,以後醫生可以再以更慢的速度減藥。在怡諾思®緩釋膠囊的臨床研究中常以每1周減少日劑量75毫克逐漸減藥,臨床上可依據劑量、療程和患者個體差異決定逐漸減量的時間。
與單胺氧化酶抑制劑(MAOI)換用
至少停用 MAOI 14 天以後才能開始使用怡諾思®緩釋膠囊,另外,至少停用怡諾思®緩釋膠囊 7 天以後才能開始MAOI 的治療(見[禁忌]和[注意事項] - 警告)。
初始治療
各種類型抑鬱症
對於多數患者,推薦怡諾思®緩釋膠囊的起始劑量為每天75毫克,單次服藥。在怡諾思®緩釋膠囊治療門診中度抑鬱症患者的臨床研究中,起始劑量為每天75毫克。對某些新發病患者,在調整劑量增至每日75毫克前,可能更適於每日37.5毫克起始治療4至7天。雖然劑量和抗抑鬱作用的關係未能充分探討,但一些患者對每天75毫克的劑量無效時可能在劑量提高到最大約每天225毫克有效,因為在大部分患者文拉法辛和主要代謝產物到第4天達到穩態濃度,如果必要可以在4天以上的間隔,以增量可達75毫克/日的幅度加量。在評估療效的研究中,允許在2周以上的間隔進行藥物的滴定,平均劑量約為每天140~180毫克(見[臨床試驗])。
尚不知對較嚴重的抑鬱症患者是否應使用高於每天225毫克劑量的怡諾思®緩釋膠囊,目前尚缺乏怡諾思®緩釋膠囊劑量高於每天225毫克的經驗(見[注意事項] -用於有伴發疾病的患者)。
廣泛性焦慮症
對於多數患者,推薦怡諾思®緩釋膠囊的起始劑量為每天75毫克,單次服藥。在怡諾思®緩釋膠囊治療門診廣泛性焦慮症療效的臨床研究中,起始劑量為每天75毫克最大劑量為每天225毫克。對某些新發病患者,在調整劑量增至每日75毫克前,可能更適於每日37.5毫克起始治療4至7天。雖然在固定劑量的研究中未能明確證實治療GAD的量效關係,但一些患者對每天75毫克的劑量無效時可能在劑量提高到約每天225毫克有效,如果必要可以在4天以上的間隔,以增量可達75毫克/日的幅度加量(見[注意事項] -用於有伴發疾病的患者)。
從鹽酸文拉法辛常釋片換用緩釋膠囊
當前套用鹽酸文拉法辛常釋片治療的抑鬱症患者可以換用每日治療劑量幾乎等同的緩釋膠囊,如服用37.5mg文拉法辛每日兩次,可換用75mg的緩釋膠囊,每日一次。必要時需要根據患者的個體情況進行調整。
特殊人群
對孕期後3個月的孕婦的治療
在第7孕月以後暴露於怡諾思®緩釋膠囊、其它5-羥色胺和去甲腎上腺素再攝取抑制劑(SNRIs)和選擇性5-羥色胺再攝取抑制劑(SSRIs)的新生兒,其需要呼吸支持、胃管餵養和延長住院等併發症的發生率增加(見[孕婦及哺乳期婦女用藥])。在孕期的後3個月使用怡諾思®緩釋膠囊時醫生應仔細權衡利弊,需要考慮減量。
肝功能不全患者
肝硬化和輕至中度肝功能不全的患者與健康者相比,文拉法辛和O-去甲基文拉法辛(ODV)的清除半衰期延長、清除率下降(見[藥代動力學]),對於輕度至中度肝功能不全的患者每日總劑量必須減少50%。對於有些患者,甚至有必要將劑量減少50%以上。因為肝硬化患者的藥物清除率有較大個體差異,個體化用藥較合適。
腎功能不全患者
腎功能不全患者(GFR=10~70 mL/min)與健康者相比,文拉法辛的清除率下降、文拉法辛和ODV的清除半衰期延長(見[藥代動力學]),每日總劑量必須減少25%~50%。接受透析治療的患者,每日總劑量必須減少50%。因為腎功能不全患者的藥物清除率有較大個體差異,對於某些患者應當個體化用藥。
兒童
尚無 18 歲以下患者適用本品的安全性和有效性的數據。
老年患者
老年患者無需因為年齡調整劑量。然而如同用於抑鬱症和GAD的其它藥物,老年患者用藥應謹慎,劑量應個體化,如果需要增加劑量,應仔細監測患者情況。
維持治療
尚無來自於對照研究肯定的依據表明怡諾思®緩釋膠囊治療抑鬱症和GAD時需要治療多長時間。一般認為在治療抑鬱症的急性症狀有效後,需要藥物鞏固治療數月或更長時間。在1項研究中,怡諾思®緩釋膠囊治療8周有效的患者,隨機分為安慰劑治療組、與先前治療劑量相同的怡諾思®緩釋膠囊(每天上午75、150或225 毫克)治療組,維持治療26周證實了怡諾思®緩釋膠囊的長期療效。
根據這些有限的資料,還不知道怡諾思®緩釋膠囊維持治療的劑量是否應等於初始治療的有效劑量。治療中應定期重新評估維持治療的必要性和合適的劑量。
怡諾思®緩釋膠囊在為期6個月的臨床研究中顯示對於GAD患者的治療有效。對於怡諾思®緩釋膠囊治療有效的GAD患者繼續用藥的必要性應該定期重新評估。
停用怡諾思®緩釋膠囊
和怡諾思®緩釋膠囊、其它SNRIs和SSRIs停藥相關的症狀已有報告(見[注意事項])。當患者停藥時應注意監測這些症狀,儘可能推薦逐漸減量而不是突然停藥。如果使用文拉法辛超過6周,建議逐漸減量時間最少要多於兩周。如果在減藥或停藥過程中出現不能耐受的反應,可以考慮恢復至先前的處方劑量,以後醫生可以再以更慢的速度減藥。在怡諾思®緩釋膠囊的臨床研究中常以每1周減少日劑量75毫克逐漸減藥,臨床上可依據劑量、療程和患者個體差異決定逐漸減量的時間。
與單胺氧化酶抑制劑(MAOI)換用
至少停用 MAOI 14 天以後才能開始使用怡諾思®緩釋膠囊,另外,至少停用怡諾思®緩釋膠囊 7 天以後才能開始MAOI 的治療(見[禁忌]和[注意事項] - 警告)。
不良反應
按CIOMS 不良反應發生率的分類,對不良反應列表如下:
非常常見 ≥ 10%
常見: ≥ 1%和[10%
少見: ≥ 0.1%和[ 1%
罕見: ≥ 0.01%和[ 0.1%
非常罕見: [ 0.01%
未知發生率: 從已有的數據中無法估計
身體各系統 不良反應
全身症狀
常見: 乏力/疲勞,寒戰;
少見: 血管性水腫,光過敏反應;
非常罕見: 過敏反應;
心血管系統
常見: 高血壓,血管擴張(多為潮紅),心悸;
少見: 低血壓,直立性低血壓,心動過速;
非常罕見: 心電圖QT 間期延長,心室纖維性顫動,室性心動過速(包括torsade de pointes 綜合徵);
消化系統
非常常見: 噁心,口乾
常見: 食慾下降,便秘,嘔吐;
少見: 夜間磨牙,腹瀉;
非常罕見: 胰腺炎;
血液和淋巴系統
少見: 瘀斑,出血(黏膜出血),胃腸道出血;
罕見: 出血時間延長,血小板減少症;
非常罕見: 血液疾病(包括粒細胞缺乏,再生障礙性貧血,中性白細胞減少症和全血細胞減少);
代謝和營養
常見: 血膽固醇增高,體重減輕;
少見: 肝功能檢測異常,低鈉血症,體重增加;
罕見: 肝炎,抗利尿激素分泌異常綜合徵;
非常罕見: 血液催乳素增加;
肌肉骨骼
非常罕見: 橫紋肌溶解;
神經系統
非常常見: 頭痛,頭暈
常見: 夢境異常,性慾下降,肌張力增加,失眠,神經質,感覺異常,鎮靜,震顫,意識模糊狀態,嗜睡,人格解體;
少見: 情感淡漠,幻覺,肌陣攣,激越,協調障礙,平衡障礙,暈厥,靜坐不能/精神運動性不安,現實感喪失,輕躁狂;
罕見: 驚厥,躁狂發作,神經阻滯劑惡性綜合徵,5-羥色胺綜合徵;
非常罕見: 譫妄; 錐體外系反應(包括肌張力障礙,運動障礙),遲發性運動障礙;
未知發生率: 自殺意念和行為、眩暈、攻擊
呼吸系統
常見: 呵欠;
少見: 呼吸困難;
非常罕見: 肺嗜酸細胞增多症;
皮膚
非常常見: 多汗(包括夜汗);
少見: 皮疹,脫髮,血管性水腫;
非常罕見: 多形性紅斑,Stevens Johnson 綜合徵, 瘙癢,蕁麻疹;
未知發生率: 中毒性表皮壞死松解症
特殊感覺
常見: 眼調節異常,瞳孔擴大,視覺障礙(包括視物模糊),耳鳴;
少見: 味覺障礙;
非常罕見: 閉角型青光眼;
泌尿生殖系統
常見: 射精異常,性快感缺失,勃起功能障礙,排尿困難(多為排尿躊躇),與出血增加或者不規則出血相關(例如,月經過多,子宮不規則出血)的月經失調,尿頻;
少見: 異常高潮(女性),尿瀦留;
罕見: 尿失禁;
外傷,中毒及術後/手術/操作性併發症
未知發生率: 骨折
文拉法辛被突然停用、劑量降低或逐漸減少時,有報告以下的症狀:輕躁狂、焦慮、激越、神經質、意識模糊、失眠或其它睡眠干擾、疲勞、嗜睡、感覺異常、頭暈、驚厥、眩暈、頭痛、流行性感冒樣症狀、耳鳴、協調和平衡障礙、震顫、出汗、口乾、厭食、腹瀉、噁心或嘔吐。在上市前的研究中,絕大多數的停藥反應是輕度的並且無需治療即可恢復。
兒童患者
總體而言,文拉法辛在兒童/青少年(6-17 歲)中的不良反應與成人相似。例如:可出現食慾下降、體重減輕、血壓升高和膽固醇升高。
在兒童的臨床試驗中,觀察到有自殺意念的不良反應發生。另外敵意和自傷的報告也增多,自傷尤見於抑鬱症患者。
特別地,還可見以下不良事件:消化不良、腹痛、激越、淤斑、鼻衄和肌痛。
非常常見 ≥ 10%
常見: ≥ 1%和[10%
少見: ≥ 0.1%和[ 1%
罕見: ≥ 0.01%和[ 0.1%
非常罕見: [ 0.01%
未知發生率: 從已有的數據中無法估計
身體各系統 不良反應
全身症狀
常見: 乏力/疲勞,寒戰;
少見: 血管性水腫,光過敏反應;
非常罕見: 過敏反應;
心血管系統
常見: 高血壓,血管擴張(多為潮紅),心悸;
少見: 低血壓,直立性低血壓,心動過速;
非常罕見: 心電圖QT 間期延長,心室纖維性顫動,室性心動過速(包括torsade de pointes 綜合徵);
消化系統
非常常見: 噁心,口乾
常見: 食慾下降,便秘,嘔吐;
少見: 夜間磨牙,腹瀉;
非常罕見: 胰腺炎;
血液和淋巴系統
少見: 瘀斑,出血(黏膜出血),胃腸道出血;
罕見: 出血時間延長,血小板減少症;
非常罕見: 血液疾病(包括粒細胞缺乏,再生障礙性貧血,中性白細胞減少症和全血細胞減少);
代謝和營養
常見: 血膽固醇增高,體重減輕;
少見: 肝功能檢測異常,低鈉血症,體重增加;
罕見: 肝炎,抗利尿激素分泌異常綜合徵;
非常罕見: 血液催乳素增加;
肌肉骨骼
非常罕見: 橫紋肌溶解;
神經系統
非常常見: 頭痛,頭暈
常見: 夢境異常,性慾下降,肌張力增加,失眠,神經質,感覺異常,鎮靜,震顫,意識模糊狀態,嗜睡,人格解體;
少見: 情感淡漠,幻覺,肌陣攣,激越,協調障礙,平衡障礙,暈厥,靜坐不能/精神運動性不安,現實感喪失,輕躁狂;
罕見: 驚厥,躁狂發作,神經阻滯劑惡性綜合徵,5-羥色胺綜合徵;
非常罕見: 譫妄; 錐體外系反應(包括肌張力障礙,運動障礙),遲發性運動障礙;
未知發生率: 自殺意念和行為、眩暈、攻擊
呼吸系統
常見: 呵欠;
少見: 呼吸困難;
非常罕見: 肺嗜酸細胞增多症;
皮膚
非常常見: 多汗(包括夜汗);
少見: 皮疹,脫髮,血管性水腫;
非常罕見: 多形性紅斑,Stevens Johnson 綜合徵, 瘙癢,蕁麻疹;
未知發生率: 中毒性表皮壞死松解症
特殊感覺
常見: 眼調節異常,瞳孔擴大,視覺障礙(包括視物模糊),耳鳴;
少見: 味覺障礙;
非常罕見: 閉角型青光眼;
泌尿生殖系統
常見: 射精異常,性快感缺失,勃起功能障礙,排尿困難(多為排尿躊躇),與出血增加或者不規則出血相關(例如,月經過多,子宮不規則出血)的月經失調,尿頻;
少見: 異常高潮(女性),尿瀦留;
罕見: 尿失禁;
外傷,中毒及術後/手術/操作性併發症
未知發生率: 骨折
文拉法辛被突然停用、劑量降低或逐漸減少時,有報告以下的症狀:輕躁狂、焦慮、激越、神經質、意識模糊、失眠或其它睡眠干擾、疲勞、嗜睡、感覺異常、頭暈、驚厥、眩暈、頭痛、流行性感冒樣症狀、耳鳴、協調和平衡障礙、震顫、出汗、口乾、厭食、腹瀉、噁心或嘔吐。在上市前的研究中,絕大多數的停藥反應是輕度的並且無需治療即可恢復。
兒童患者
總體而言,文拉法辛在兒童/青少年(6-17 歲)中的不良反應與成人相似。例如:可出現食慾下降、體重減輕、血壓升高和膽固醇升高。
在兒童的臨床試驗中,觀察到有自殺意念的不良反應發生。另外敵意和自傷的報告也增多,自傷尤見於抑鬱症患者。
特別地,還可見以下不良事件:消化不良、腹痛、激越、淤斑、鼻衄和肌痛。
禁忌
禁用於對鹽酸文拉法辛或任何賦形劑過敏的患者。
禁用於同時服用MAOIs 的患者:在停用MAOIs 後至少14 天內不得開始使用文拉法辛,對於可逆性單胺氧化酶抑制劑,此間期可相應縮短(參考可逆性單胺氧化酶抑制劑的說明書);停用文拉法辛至少7 天后方可開始以MAOIs 進行治療。
禁用於同時服用MAOIs 的患者:在停用MAOIs 後至少14 天內不得開始使用文拉法辛,對於可逆性單胺氧化酶抑制劑,此間期可相應縮短(參考可逆性單胺氧化酶抑制劑的說明書);停用文拉法辛至少7 天后方可開始以MAOIs 進行治療。
注意事項
警告:
臨床症狀的惡化和自殺風險
患有抑鬱症的成年和兒童患者,無論是否服用抗抑鬱藥物,他們的抑鬱症都有可能惡化,並有可能出現自殺意念和自殺行為以及行為異常變化,這種風險一直會持續到病情發生明顯緩解時為止。已知抑鬱和某些精神障礙與自殺風險有關,並且這些精神障礙本身為自殺的最強的預兆。然而,長期以來一直有這些的擔憂:在某些患者治療早期,抗抑鬱藥物可能對誘導抑鬱症狀惡化,以及產生自殺意念、行為中起著作用。抗抑鬱藥物(SSRIs和其他)短期安慰劑對照研究匯總分析顯示,在患有抑鬱症(MDD)和其它精神障礙的兒童、青少年和青年(18-24 歲)中,與安慰劑相比,抗抑鬱藥物增加了產生自殺想法和實施自殺行為(自殺意念、行為)的風險。但短期的臨床試驗沒有顯示,在年齡大於24歲的成年人中,與安慰劑相比,使用抗抑鬱藥物會增加自殺意念、行為的風險;在年齡65歲及以上的成年人中,使用抗抑鬱藥物後,自殺意念、行為的風險有所降低。
在患有抑鬱症、強迫症(OCD)或其它精神障礙的兒童和青少年中進行的安慰劑對照試驗(總計24項短期臨床試驗,9種抗抑鬱藥物,包括愈4400例患者)和在患有抑鬱症或其它精神障礙的成年患者中進行的安慰劑對照試驗(總計295項短期臨床試驗(中位持續時間為2個月),11種抗抑鬱藥物,愈77000例患者),各種藥物引起的自殺意念、行為的風險有很大的差異,但是大部分的藥物研究顯現出較年輕患者自殺意念、行為風險增加的趨勢。在各個不同的適應症中,自殺意念、行為的絕對風險不同,在抑鬱症中的絕對風險最高。雖然在各個適應症中的絕對風險有所不同(藥物和安慰劑相比),但是,在不同適應症的年齡層中的風險相對穩定。表1提供了風險差異(每1000名患者中藥物和安慰劑治療產生的自殺意念、行為風險差異的例數)。
在兒童臨床試驗中沒有自殺事件發生。在成人臨床試驗中有自殺事件的發生,但是發生的數量不足以對藥物在自殺中的影響做出結論。
自殺意念、行為的風險在長期用藥過程中(如幾個月後)是否會延續尚不可知。但是,從在成年抑鬱症患者中進行的安慰劑對照的維持治療臨床試驗的證據充分顯示,使用抗抑鬱藥物可以延緩抑鬱症的復發。
無論治療哪種適應症,對接受抗抑鬱藥物治療的所有患者,都應當適當監察和密切觀察其臨床症狀惡化、自殺傾向以及行為變化異常情況。尤其在藥物最初治療的數月內,及增加或減少劑量的時候。
用抗抑鬱藥物治療患有抑鬱症、其它精神病性或非精神病性障礙的成年和兒童患者時,可以出現下列症狀:焦慮、激越、驚恐發作、失眠、易激惹、敵意、攻擊性、衝動、靜坐不能(精神運動性不安)以及輕躁狂和躁狂。雖然尚未建立這些症狀的出現與抑鬱症的惡化和/或自殺衝動的產生之間的因果關係,但注意到了這些症狀的出現可能是產生自殺傾向的先兆。
當患者的抑鬱症狀持續惡化,出現自殺傾向,或出現可能是抑鬱症狀惡化或自殺傾向的先兆症狀時,應當仔細考慮包括可能中止藥物治療在內的治療方案調整。如果這些症狀是嚴重的、突發的、或與患者當前症狀不符合時更應如此。
如果決定中止治療,劑量應當儘快遞減,但需意識到突然停藥可能會引起某些症狀(參見[注意事項]和[用法用量],停止怡諾思®緩釋膠囊治療中的風險描述)。
用抗抑鬱藥物治療患有抑鬱症或其它精神病性或非精神病性障礙的兒童患者時,應當提醒家屬以及看護者有必要監察患者是否出現激越、易激惹、行為異常變化、其它以上提及的症狀以及出現自殺傾向的情況,一旦出現,立即向醫療衛生專業人士匯報這些症狀。家屬以及看護者應當每日對患者進行以上監察。使用怡諾思®緩釋膠囊時,處方應當從最小量開始,並配合良好的患者管理,以減少過量用藥的危險。
雙相情感障礙患者的篩查:
抑鬱發作可能是雙相情感障礙的初期表現。一般認為(雖然未通過對照試驗明確),單用抗抑鬱藥物治療這類發作可能增加具有雙相情感障礙危險患者的混合型/躁狂發作的可能性。尚不明確以上提及的症狀是否意味著可能出現這種轉變。然而,在用抗抑鬱藥物開始治療之前,應當對有抑鬱症狀的患者進行充分的篩查,以確定他們是否具有雙相情感障礙的危險;該篩查應當包括自殺家族史,雙相情感障礙和抑鬱症家族史在內詳細的精神病史。應當注意怡諾思®緩釋膠囊未經批准用於治療雙相情感障礙的抑鬱發作。
對使用文拉法辛的所有患者應當給予適當監測和密切觀察臨床症狀惡化和自殺行為,應當提醒患者、家人以及看護者警惕患者是否出現焦慮、激越、驚恐發作、失眠、易激惹、敵意、攻擊性、衝動、靜坐不能(精神運動性不安)、輕躁狂、躁狂、其它行為異常變化、抑鬱症狀惡化以及出現自殺傾向的情況,尤其在開始治療或者是改變劑量或改變劑量方案期間。必須考慮可能存在自殺企圖的風險,尤其對抑鬱症患者,應當給予最小包裝量(即盒數)的藥物,同時對患者進行有效管理,以減少過量的風險(見[兒童用藥]和[不
良反應])。
已知自殺行為預示著抑鬱症和其他某些精神疾病的風險,反之這些疾病本身也是自殺的高危因素。匯總分析短期、安慰劑對照試驗顯示治療抑鬱症和其他精神疾病時,抗抑鬱藥物(SSRIs和其它)會增加兒童、青少年和青年(18-24歲)的自殺風險。短期的對照試驗研究未顯示在24歲以上的成人中使用抗抑鬱藥物,自殺的風險與安慰劑相比有所增加。
在65歲及以上的成人中使用抗抑鬱藥物,自殺的風險與安慰劑相比有所減少。
類似其它5-羥色胺能藥物,使用文拉法辛治療尤其是在合併使用其它作用於5-羥色胺遞質系統的藥物(包括SSRIs、SNRIs 和曲坦)、或可能損害5-羥色胺代謝的藥物(包括MAOIs,例如:亞甲藍)或抗精神病藥或其他多巴胺拮抗劑時,可能會發生潛在威脅生命的5-羥色胺綜合徵或神經阻滯劑惡性綜合徵(NMS)樣反應。5-羥色胺綜合徵可能包括精神狀態改變(例如:激越、幻覺和昏迷)、自主神經不穩定(例如:心動過速、血壓不穩和高熱)、神經肌肉失常(例如:反射亢進、平衡失調)和/或胃腸道反應(例如:噁心、嘔吐和腹瀉)。5-羥色胺綜合徵最嚴重的表現形式和NMS 相似,包括高熱、肌僵硬、伴有可能生命體徵快速波動的自主神經不穩定和精神狀態改變。(見[藥物相互作用] -5-羥色胺綜合徵)。
如果臨床上有合理需要,要合併使用文拉法辛和其他能影響5-羥色胺能和/或多巴胺能神經遞質系統的藥物,建議仔細觀察病人,尤其在治療初始和劑量增加階段。
不建議合併使用文拉法辛和5-羥色胺前體(如:色氨酸補充劑)。
與單胺氧化酶抑制劑(MAOIs)潛在的相互作用如果停用MAOIs 不久後開始文拉法辛治療,或停用文拉法辛不久就開始MAOIs 治療,可能會發生不良反應、有時甚至是嚴重不良反應。這些不良反應包括震顫、肌痙攣、多汗、噁心、嘔吐、潮紅、頭暈、伴有類似於惡性綜合徵的高熱、癲癇發作、以至死亡。
已有關於藥理作用類似於怡諾思緩釋膠囊的其它抗抑鬱藥合併MAOIs 產生嚴重、甚至致死性的不良反應報告。如MAOIs 合併SSRIs 類藥物,這些不良反應還包括:高熱、強直、肌痙攣和生命體徵不穩定、精神狀態的改變(包括極度的激越,逐漸進展為譫妄和昏迷)。有報告在三環類抗抑鬱藥(TCAs)合併MAOIs 治療的一些病例中出現惡性綜合徵(嚴重高熱、癲癇發作),有時可以致命。在停用TCAs 後很快使用MAOIs 治療的患者中也有類似報告。尚無合併使用文拉法辛和MAOIs 的人體和動物研究,因為文拉法辛同時抑制是去甲腎上腺素和5-HT 的再攝取,因此怡諾思緩釋膠囊不能與MAOIs 同時服用,在至少停用MAOIs 14 天后,才能使用本品,或者至少停用本品7 天后,才能使用MAOIs。
5-羥色胺綜合徵
使用怡諾思®緩釋膠囊治療時,可能發生一種潛在生命威脅的5-羥色胺綜合徵或者抗精神藥物惡性綜合徵(NMS)樣反應,尤其是在與以下藥物合併使用時:作用於5-羥色胺遞質系統的藥物(包括SSRIs、SNRIs和曲坦)和損害5-羥色胺代謝的藥物,(包括MAOIs,例如亞甲藍)或合併套用抗精神病藥物或其他多巴胺拮抗劑。5-羥色胺綜合徵可能包括精神狀態的改變(例如,激越、幻覺、昏迷)、自主神經不穩定(例如,心動過速、血壓不穩、高熱)、神經肌肉系統失調(例如,反射亢進、動作失調)和/或胃腸道症狀(例如,噁心、嘔吐、腹瀉)。最嚴重的5-羥色胺綜合徵與抗精神病藥物惡性綜合徵的表現相似,包括高熱、肌肉強直、自主神經不穩定可能伴有生命體徵的快速波動,以及精神狀態的改變。(見 [藥物相互作用] )。
禁止怡諾思®緩釋膠囊與MAIOs合用治療抑鬱症(見[禁忌]和[注意事項]-警告,與單胺氧化酶抑制劑(MAOIs)潛在的相互作用)。
如果臨床上有合理需要,要合併使用文拉法辛和某種SSRI、SNRI或5-羥色胺受體激動劑(曲坦),建議密切觀察患者情況,尤其在治療初期和增加劑量時(見[藥物相互作用])。
不推薦合併使用文拉法辛和5-羥色胺前體物質(如:色氨酸補充劑)(見[藥物相互作用])。
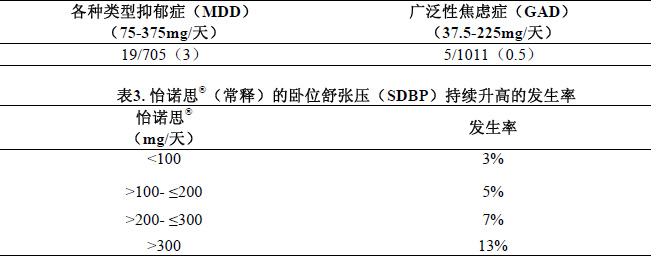
持續性高血壓
文拉法辛的治療與部分患者持續的血壓升高有關(定義為臥位舒張壓(SDBP)≥90mmHg,並且連續3次血壓監測高於基線血壓10 mmHg,見表2)。
在對符合持續性高血壓標準的服用怡諾思®(常釋)患者分析顯示,使用怡諾思®(常釋)發生持續性高血壓的發生率與劑量增加有關(見表3)。
為了充分評價在高劑量下的血壓持續性升高的發生率,進行了接受平均劑量大於300mg/天怡諾思®緩釋膠囊的研究,但病例數較少。
表2 .怡諾思®緩釋膠囊上市前根據不同的適應症劃分,發生臥位舒張壓(SDBP)持續升高的數目(%)
上市前怡諾思緩釋膠囊治療抑鬱症患者的研究中,有0.7% (5/705)的患者由於血壓的升高而中止治療,其中大部分患者是中度的血壓升高(SDBP升高12到16 mm Hg)。在治療GAD的2項研究中,在8周或6個月的隨訪期內分別有0.7% (10/1381)和1.3% (7/535)的患者由於血壓的升高而中止,其中大部分患者是中度的血壓升高(8周時SDBP升高12到25 mmHg,6個月時升高8到28 mm Hg)。
持續的SDBP升高會產生不利的後果,在上市後的研究中,有報告需要立刻治療的高血壓發生,在使用文拉法辛進行治療前,必須對已有的高血壓進行控制。推薦在使用怡諾思緩釋膠囊治療的患者中應定期監測血壓。對於使用文拉法辛治療後出現持續性血壓升高的患者,應考慮減藥或停止治療。
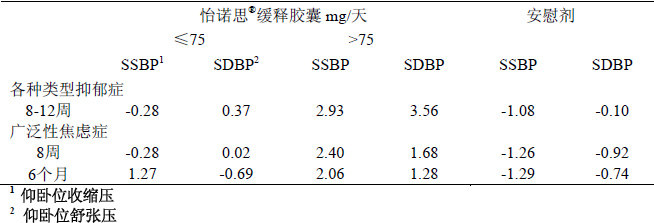
收縮壓和舒張壓升高
在安慰劑對照的上市前研究中,平均血壓的變化見表4 仰臥位收縮壓和舒張壓的平均變化。在不同的適應症間,在怡諾思®緩釋膠囊治療的患者中證實仰臥位收縮和舒張壓與劑量的增加相關。
表4. 安慰劑對照臨床試驗中,不同適應症、試驗持續時間和劑量組的仰臥位收縮壓和舒張壓與基線相比的平均變化
在抑鬱症和廣泛性焦慮症的所有臨床試驗間,接受怡諾思®緩釋膠囊治療的患者仰臥位舒張壓升高≥15 mmHg的占1.4%(舒張壓≥105 mmHg),而安慰劑為0.9%。同樣的接受怡諾思®緩釋膠囊治療的患者仰臥位收縮壓升高≥20 mmHg的占1%(收縮壓≥180mmHg),而安慰劑為0.3%。
瞳孔擴大
有患者出現瞳孔擴大現象,可能與文拉法辛的治療有關。因此對有眼壓增高或者急性窄角型青光眼(閉角型青光眼)的患者應密切監測。
骨折
流行病學研究顯示套用五羥色胺再攝取抑制劑(SRIs)包括文拉法辛治療的患者骨折風險增加。但骨折風險的機制尚不明確。
一般注意事項:
停用怡諾思緩釋膠囊
對於使用文拉法辛治療的患者停藥時應系統評估其停藥症狀,包括文拉法辛治療GAD的臨床研究的前瞻性分析和治療抑鬱症的回顧性調查的結果。當患者突然的停藥或高劑量藥物減少時會出現一些新的症狀,出現的頻率隨著藥物的劑量和治療時間的增加而增高。
報告的症狀包括:激越、厭食、焦慮、意識模糊、協調和平衡障礙、腹瀉、頭暈、口乾、情緒煩躁、肌束震顫、疲勞、頭痛、輕躁狂、失眠、噁心、神經質、惡夢、感覺異常(電擊樣感覺)、嗜睡、出汗、震顫、眩暈和嘔吐。
在怡諾思緩釋膠囊、其它SNRIs和SSRIs上市後陸續有一些停藥後不良事件自發的報告,尤其在突然停藥時常可見:情緒煩躁、易激惹、激越、頭暈、感覺異常(如電擊感)、焦慮、意識模糊、頭痛、昏睡、情緒不穩定、失眠、輕躁狂、耳鳴和癲癇發作等。
以上表現一般為自限性,也有嚴重停藥反應的報告。
當患者停用怡諾思緩釋膠囊時,應注意監測這些可能出現的停藥症狀。推薦任一劑型的文拉法辛均應逐漸減量,避免突然停藥,並且對患者進行監控。如果在減藥和停藥過程中出現難以耐受的症狀時,可以考慮恢復至先前治療劑量,隨後醫生再以更慢的速度減藥(見[用法用量])。
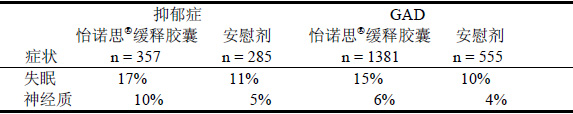
失眠和神經質
在怡諾思緩釋膠囊短期治療抑鬱症和GAD時,與安慰劑相比,常引起失眠和神經質。見表5。
表 5. 治療抑鬱症和GAD的安慰劑對照研究中失眠和神經質的發生率
在使用怡諾思緩釋膠囊治療抑鬱症時,患者分別由於失眠和神經質導致停藥的發生率均為0.9%。
在怡諾思緩釋膠囊治療GAD的研究中,在治療8周以上的患者中由於失眠和神經質導致停藥的發生率分別為3%和2%,在治療6個月以上的患者中分別為2%和0.7%。
體重的變化
成年患者:臨床研究顯示有7%接受怡諾思緩釋膠囊和2%接受安慰劑治療的抑鬱症患者體重下降超過5%。因為體重下降而停藥的患者比例為0.1%。在與安慰劑對照治療GAD的研究中,6個月後怡諾思緩釋膠囊組和安慰劑組分別有3%和1%的患者體重下降超過7%。隨訪至8周時有0.3%服用怡諾思緩釋膠囊的GAD患者因為體重下降停藥。
文拉法辛合併減肥藥(如芬特明)的療效和安全性尚未明確,建議不合併使用文拉法辛和減肥藥。文拉法辛也未批准單獨或合併用於降低體重的治療。
兒童患者:兒童患者接受怡諾思緩釋膠囊治療有體重下降的報告。對於4項怡諾思緩釋膠囊雙盲、安慰劑對照可變劑量治療抑鬱症為期8周的臨床研究的匯總分析顯示,怡諾思緩釋膠囊治療的患者體重平均下降0.45kg(n=333),安慰劑組患者的體重下降為0.77kg(n=333)。在抑鬱症和GAD的患者的治療中,怡諾思緩釋膠囊與安慰劑相比有更多患者體重下降至少達到3.5%(怡諾思緩釋膠囊組的18%比安慰劑組的3.6%,p [0.001)。因治療而引起的厭食症狀對患者體重下降的影響可能更廣,難以評價(見[注意事項] - 食慾的變化)。
在一項開放的兒童和青少年接受怡諾思®緩釋膠囊6個月治療抑鬱症的研究中,評價藥物長期治療的風險。結果顯示,用怡諾思®緩釋膠囊的兒童和青少年體重的增加少於那些年齡和性別匹配的兒童和青少年的預期體重增加值。這種差異在兒童中([12歲)比在青少年中(]12歲)更為明顯。
身高的變化
兒童患者:在8周的安慰劑對照治療GAD的研究中,怡諾思緩釋膠囊治療的患者(年齡6~17歲)的身高平均增加0.3cm(n=132),安慰劑組平均增加1.0cm(n=132),p=0.041。這種身高增加的差異在低於12歲的患者中更為明顯。在為期8周安慰劑對照治療抑鬱症的研究中,怡諾思緩釋膠囊治療的患者的身高平均增加0.8cm (n=146),安慰劑組為0.7cm(n=147)。在1項6個月的抑鬱症開放研究中,接受治療的兒童和青少年身高增長,但低於其基於年齡和性別相匹配的預期值,年齡[12歲的兒童的這種實際身高與預期身高的差異更大。
食慾的變化
成年患者:通過對短程、雙盲和安慰劑對照治療抑鬱症的研究的匯總分析,怡諾思緩釋膠囊治療組比安慰劑組有更多的患者出現厭食,分別達到8%和4%。治療抑鬱症的過程中有1%的患者因為厭食停用怡諾思緩釋膠囊。通過對短程、雙盲和安慰劑對照治療GAD的研究的匯總分析,在怡諾思緩釋膠囊治療組比安慰劑組有更多的患者出現厭食,分別達到8%和2%,在8周的治療期內,有0.9%的GAD患者因為厭食停用怡諾思緩釋膠囊。
兒童患者:怡諾思緩釋膠囊和安慰劑對照治療的GAD抑鬱症的兒童患者中也出現厭食,有10%的年齡在6~17歲的患者服用怡諾思緩釋膠囊過程出現厭食,安慰劑組為3%。沒有患者因為厭食和體重下降而停用怡諾思緩釋膠囊。
誘發躁狂/輕躁狂
上市前的臨床研究顯示:用於治療抑鬱症時,有0.3%的服用怡諾思緩釋膠囊的患者出現躁狂或輕躁狂,安慰劑組為0%;用於治療GAD時,服用怡諾思緩釋膠囊的患者無一出現躁狂或輕躁狂,安慰劑組躁狂或輕躁狂發生率為0.2%。在所有的怡諾思(常釋)治療抑鬱症的研究中,服用文拉法辛的患者中有0.5%發生躁狂或輕躁狂,而安慰劑組卻未發生。據報告已上市的抗抑鬱藥物(包括文拉法辛)治療抑鬱症時也有少數的患者出現躁狂或輕躁狂。和所有的抗抑鬱藥物一樣,怡諾思緩釋膠囊慎用於有雙相情感障礙病史或家族史的患者。
攻擊性行為
較小比例的曾經接受抗抑鬱藥物治療(包括文拉法辛的治療,降低劑量和中斷治療)的患者可能發生攻擊性行為。與使用其它抗抑鬱藥物類似,對於具有攻擊性傾向病史的患者使用文拉法辛需要謹慎。
低鈉血症
通常在低血容量或者脫水患者中,使用SSRIs和SNRIs藥物包括文拉法辛時可能發生低鈉血症和/或抗利尿激素分泌異常綜合徵。老年患者、服用利尿劑的患者和由於其他原因導致的低血容量者,有較大的風險出現低鈉血症。在大多數情況下,低鈉血症是由於抗利尿素分泌異常綜合徵(SIADH)引起的。有病例報告血清鈉低於110mmol/L。對於出現低鈉血症症狀的患者應考慮停用怡諾思®緩釋膠囊,並且採取合適的醫學干預措施。
低鈉血症的症狀包括頭痛、思想集中困難、記憶損傷、意識模糊、虛弱、可能導致跌倒的搖擺不定。嚴重或急性的症狀包括幻覺、暈厥、癲癇發作、昏迷、呼吸停止和死亡。
驚厥
如同其它抗抑鬱藥,文拉法辛可能會引起驚厥。有驚厥史的患者應慎用。
癲癇發作在上市前的臨床研究中,所有的705例接受怡諾思緩釋膠囊治療的抑鬱症患者和1381例GAD患者中沒有出現癲癇發作。在所有的怡諾思®(常釋)上市前研究中,在接受不同劑量文拉法辛治療的患者中有0.3%(8/3082)出現癲癇發作。和其它抗抑鬱藥物一樣,怡諾思緩釋膠囊應慎用於有癲癇發作病史的患者,當患者癲癇發作時應停藥。
異常出血
SSRIs和SNRIs,包括怡諾思®緩釋膠囊,可能增加出血事件發生的風險。與阿司匹林、非甾體類的抗炎藥、華法令和其它抗凝藥合併使用可能會增加該風險。病例報告和流行病學研究(病例對照和組群設計)已經證明干擾5-羥色胺再攝取的藥物與胃腸道出血的相關性。與使用SSRIs和SNRIs藥物相關的出血事件包括瘀斑、血腫、鼻衄、瘀點和有生命危險的出血。
當怡諾思®緩釋膠囊與非甾體性抗炎藥、阿司匹林或其他任何影響凝血的藥合用時,患者應注意異常出血風險。
抑制5-羥色胺再攝取的藥物可導致血小板聚集的異常。服用文拉法辛的患者皮膚及黏膜出血,包括胃腸道出血的風險可能增加。因此,和其它5-羥色胺再攝取抑制劑一樣,有出血傾向的患者,包括使用抗凝藥及血小板抑制劑的患者應慎用文拉法辛。
血清膽固醇的升高
在為期3個月以上的安慰劑對照研究中,接受文拉法辛治療的患者中有5.3%出現有臨床意義的血清膽固醇的升高,安慰劑組為0%。在長期治療的患者中應監測血清膽固醇水平。
間質性肺病和嗜酸細胞性肺炎
與使用文拉法辛治療相關的間質性肺病和嗜酸細胞性肺炎鮮有報告。在有進行性呼吸困難、咳嗽或胸部不適症狀的文拉法辛使用患者應該考慮這些不良事件的可能性,應該對這些患者立刻進行醫學評估,並且考慮停止使用文拉法辛治療。
用於有伴發疾病的患者
在上市前,文拉法辛用於伴發軀體疾病患者的經驗有限。怡諾思緩釋膠囊用於伴有軀體疾病的患者可能會影響血液動力學和代謝,處方時需加以注意。
某些使用文拉法辛的患者據報告可發生劑量相關性的血壓升高。在上市後的臨床經驗中,有報告需要立即治療的血壓升高的病例。因此使用文拉法辛的患者建議監測血壓。在進行文拉法辛治療前,應該對先前存在的高血壓進行控制。那些原有基礎疾病會因血壓升高而惡化的患者應謹慎。
對於近期心肌梗塞或不穩定心臟疾病史的患者,尚缺乏套用文拉法辛的經驗,故難以進行評價。因此這些患者應慎用該藥。在上市前研究時有這些疾病的患者均已被剔除。在治療抑鬱症為期8~12周的雙盲、安慰劑對照的研究中,有275例服用怡諾思緩釋膠囊的患者和220例服用安慰劑的患者,在1項8周雙盲、安慰劑對照治療GAD的研究中服用怡諾思緩釋膠囊的610例患者和服用安慰劑的298例患者中,通過分析上述患者的心電圖,發現採用怡諾思緩釋膠囊治療和安慰劑組的抑鬱症患者QT間期(QTc)與基線相比有所延長(服用怡諾思緩釋膠囊者延長4.7msec,安慰劑組患者縮短1.9msec),採用怡諾思緩釋膠囊治療和安慰劑組GAD患者QT間期(QTc)與基線相比無明顯變化。
在這些研究中,對於抑鬱症的治療,接受怡諾思緩釋膠囊治療的患者的心率相對於基線的變化明顯高於安慰劑組(怡諾思緩釋膠囊組平均增加4次/分鐘,安慰劑組為1次/分鐘)。治療GAD的研究中,接受怡諾思緩釋膠囊治療的患者的心率相對於基線的變化明顯高於安慰劑組(怡諾思緩釋膠囊組平均增加3次/分鐘,安慰劑組無變化)。
在1項可變劑量的研究中,當怡諾思(常釋)的劑量達到200~375mg/天,平均劑量高於300mg/天時,服用怡諾思的患者的心率平均增加8.5次/分鐘,而安慰劑組平均增加1.7次/分鐘。
因為怡諾思有加快心率的可能,應注意可能由於心率增加會危及伴有潛在疾病(如甲狀腺功能亢進、心力衰竭或近期的心肌梗塞)的患者的安全,尤其在服用高劑量怡諾思情況下時。因此,對於可能由於心率加快而影響健康狀況的患者應慎用該藥。
在一項為期4-6周雙盲、安慰劑對照的臨床試驗中,對其中769例服用怡諾思(常釋)患者的心電圖評估顯示,試驗引起的傳導異常發生率與安慰劑相比沒有異常。
在腎功能不全(GFR = 10 到70 mL/min)和肝硬化的患者中,由於文拉法辛及其代謝產物的清除率減低,消除半衰期延長,因此應使用較小的劑量(見[用法用量]),怡諾思緩釋膠囊和其它抗抑鬱藥一樣,對這些患者應慎用。
靜坐不能/精神運動性不安
使用文拉法辛時可出現靜坐不能,其特徵表現為主觀性的、不愉快的或令人苦惱的坐立不安,需要來回走動,並且常常伴無法靜坐或安靜站立。可能發生於治療的前幾周內。
如果患者發生了這些症狀,增加劑量可能有害。
口乾
10%套用文拉法辛的患者報告口乾。這可能會增加齲齒風險,應建議患者注重口腔衛生。
糖尿病
糖尿病患者套用SSRI 或文拉法辛,可能會影響目前的血糖水平。所以,可能需要調整胰島素和/或其他抗糖尿病口服藥物的劑量。
患者用藥信息
醫生或其他醫療衛生專業人士應當告知患者、他們的家屬和他們的看護人有關使用怡諾思®緩釋膠囊治療的利益和風險,並且告知他們正確的用藥方法。
應建議患者關注以下內容,並要求他們在服用怡諾思®緩釋膠囊時出現這些情況時及時通知醫生。
臨床症狀的惡化及自殺風險:應當鼓勵患者、他們的家屬和他們的看護者警惕下列症狀的發生:焦慮、激越、驚恐發作、失眠、易激惹、敵意、攻擊性、衝動、靜坐不能(精神運動性不安)、輕躁狂、躁狂、其它行為異常變化、抑鬱症狀惡化、自殺意念、尤其是在使用抗抑鬱藥物治療的早期和增加或減少劑量時。由於這些變化可能是突發的,因此應當建議患者的家屬和看護人每天都查找這些症狀是否出現,應當向患者的醫生或醫療衛生專業人士報告這些症狀,尤其是出現嚴重的、突發的或不同於患者主訴的症狀。因為這些症狀可能增加自殺意念和行為的發生率,有密切監察和改變藥物治療的必要。
對認知和運動功能的妨礙
雖然文拉法辛不影響健康志願者的精神運動性、認知或複雜行為的執行能力,但是任何精神活性藥物可能損害判斷、思維和運動的執行能力。因此,在明確文拉法辛不會對他們這些能力帶來負面影響前,患者在駕駛車輛和操縱危險的機器時應謹慎。
伴隨用藥
因為藥物之間有潛在相互作用的可能,建議患者正在或準備服用任何處方藥或非處方藥(包括草藥和營養補充劑)時通知醫生。
患者應該對怡諾思®緩釋膠囊合併下列藥物引起5-羥色胺綜合徵的風險保持謹慎,這些藥物包括曲坦、曲馬朵、色氨酸補充劑和其他5-羥色胺能的藥物(見[藥物相互作用])。
患者對於怡諾思®緩釋膠囊和非甾體性抗炎藥、阿司匹林、華法令或其他影響血小板凝集的藥物合用時應謹慎,因為這些藥物和影響5-羥色胺再攝取的精神治療藥物合用與出血風險增加相關(見[注意事項]-一般注意事項,異常出血)。
酒精
儘管文拉法辛不會增加酒精引起的精神和運動技能的損害,但建議患者服用文拉法辛時應戒酒。
過敏反應
建議當患者出現皮疹、蕁麻疹和與過敏有關的表現時通知他們的醫生。
妊娠
建議患者在治療期內懷孕或準備懷孕時通知她們的醫生。
哺乳
患者如果是母乳餵養嬰兒,應通知她們的醫生。
軀體和精神依賴
體外研究顯示文拉法辛對阿片受體、苯二氮艹卓受體、苯環己哌啶(PCP)受體和NMDA受體無親和力。文拉法辛對嚙齒類動物的中樞神經系統無興奮作用。在對靈長類動物的研究中,文拉法辛無明顯興奮性和鎮靜方面的濫用傾向。
文拉法辛停藥反應有所報告(見[用法用量])。
目前尚無文拉法辛是否存在潛在濫用的系統性臨床研究,其它一些臨床研究中未見覓藥行為。然而對於一個中樞神經系統(CNS)活性藥物而言,上市前臨床研究的經驗不能預示藥物上市後有無誤用和/或濫用的可能。故醫生應仔細評估和密切隨訪有藥物濫用史的患者,以及時發現他們對文拉法辛的誤用或濫用(如:耐受性增強、藥物的加量和覓藥行為)。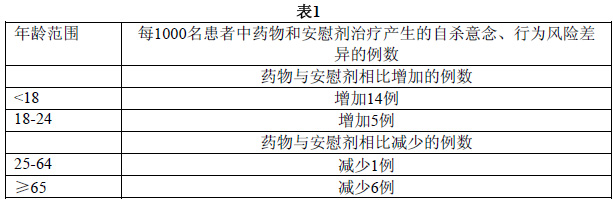
臨床症狀的惡化和自殺風險
患有抑鬱症的成年和兒童患者,無論是否服用抗抑鬱藥物,他們的抑鬱症都有可能惡化,並有可能出現自殺意念和自殺行為以及行為異常變化,這種風險一直會持續到病情發生明顯緩解時為止。已知抑鬱和某些精神障礙與自殺風險有關,並且這些精神障礙本身為自殺的最強的預兆。然而,長期以來一直有這些的擔憂:在某些患者治療早期,抗抑鬱藥物可能對誘導抑鬱症狀惡化,以及產生自殺意念、行為中起著作用。抗抑鬱藥物(SSRIs和其他)短期安慰劑對照研究匯總分析顯示,在患有抑鬱症(MDD)和其它精神障礙的兒童、青少年和青年(18-24 歲)中,與安慰劑相比,抗抑鬱藥物增加了產生自殺想法和實施自殺行為(自殺意念、行為)的風險。但短期的臨床試驗沒有顯示,在年齡大於24歲的成年人中,與安慰劑相比,使用抗抑鬱藥物會增加自殺意念、行為的風險;在年齡65歲及以上的成年人中,使用抗抑鬱藥物後,自殺意念、行為的風險有所降低。
在患有抑鬱症、強迫症(OCD)或其它精神障礙的兒童和青少年中進行的安慰劑對照試驗(總計24項短期臨床試驗,9種抗抑鬱藥物,包括愈4400例患者)和在患有抑鬱症或其它精神障礙的成年患者中進行的安慰劑對照試驗(總計295項短期臨床試驗(中位持續時間為2個月),11種抗抑鬱藥物,愈77000例患者),各種藥物引起的自殺意念、行為的風險有很大的差異,但是大部分的藥物研究顯現出較年輕患者自殺意念、行為風險增加的趨勢。在各個不同的適應症中,自殺意念、行為的絕對風險不同,在抑鬱症中的絕對風險最高。雖然在各個適應症中的絕對風險有所不同(藥物和安慰劑相比),但是,在不同適應症的年齡層中的風險相對穩定。表1提供了風險差異(每1000名患者中藥物和安慰劑治療產生的自殺意念、行為風險差異的例數)。
在兒童臨床試驗中沒有自殺事件發生。在成人臨床試驗中有自殺事件的發生,但是發生的數量不足以對藥物在自殺中的影響做出結論。
自殺意念、行為的風險在長期用藥過程中(如幾個月後)是否會延續尚不可知。但是,從在成年抑鬱症患者中進行的安慰劑對照的維持治療臨床試驗的證據充分顯示,使用抗抑鬱藥物可以延緩抑鬱症的復發。
無論治療哪種適應症,對接受抗抑鬱藥物治療的所有患者,都應當適當監察和密切觀察其臨床症狀惡化、自殺傾向以及行為變化異常情況。尤其在藥物最初治療的數月內,及增加或減少劑量的時候。
用抗抑鬱藥物治療患有抑鬱症、其它精神病性或非精神病性障礙的成年和兒童患者時,可以出現下列症狀:焦慮、激越、驚恐發作、失眠、易激惹、敵意、攻擊性、衝動、靜坐不能(精神運動性不安)以及輕躁狂和躁狂。雖然尚未建立這些症狀的出現與抑鬱症的惡化和/或自殺衝動的產生之間的因果關係,但注意到了這些症狀的出現可能是產生自殺傾向的先兆。
當患者的抑鬱症狀持續惡化,出現自殺傾向,或出現可能是抑鬱症狀惡化或自殺傾向的先兆症狀時,應當仔細考慮包括可能中止藥物治療在內的治療方案調整。如果這些症狀是嚴重的、突發的、或與患者當前症狀不符合時更應如此。
如果決定中止治療,劑量應當儘快遞減,但需意識到突然停藥可能會引起某些症狀(參見[注意事項]和[用法用量],停止怡諾思®緩釋膠囊治療中的風險描述)。
用抗抑鬱藥物治療患有抑鬱症或其它精神病性或非精神病性障礙的兒童患者時,應當提醒家屬以及看護者有必要監察患者是否出現激越、易激惹、行為異常變化、其它以上提及的症狀以及出現自殺傾向的情況,一旦出現,立即向醫療衛生專業人士匯報這些症狀。家屬以及看護者應當每日對患者進行以上監察。使用怡諾思®緩釋膠囊時,處方應當從最小量開始,並配合良好的患者管理,以減少過量用藥的危險。
雙相情感障礙患者的篩查:
抑鬱發作可能是雙相情感障礙的初期表現。一般認為(雖然未通過對照試驗明確),單用抗抑鬱藥物治療這類發作可能增加具有雙相情感障礙危險患者的混合型/躁狂發作的可能性。尚不明確以上提及的症狀是否意味著可能出現這種轉變。然而,在用抗抑鬱藥物開始治療之前,應當對有抑鬱症狀的患者進行充分的篩查,以確定他們是否具有雙相情感障礙的危險;該篩查應當包括自殺家族史,雙相情感障礙和抑鬱症家族史在內詳細的精神病史。應當注意怡諾思®緩釋膠囊未經批准用於治療雙相情感障礙的抑鬱發作。
對使用文拉法辛的所有患者應當給予適當監測和密切觀察臨床症狀惡化和自殺行為,應當提醒患者、家人以及看護者警惕患者是否出現焦慮、激越、驚恐發作、失眠、易激惹、敵意、攻擊性、衝動、靜坐不能(精神運動性不安)、輕躁狂、躁狂、其它行為異常變化、抑鬱症狀惡化以及出現自殺傾向的情況,尤其在開始治療或者是改變劑量或改變劑量方案期間。必須考慮可能存在自殺企圖的風險,尤其對抑鬱症患者,應當給予最小包裝量(即盒數)的藥物,同時對患者進行有效管理,以減少過量的風險(見[兒童用藥]和[不
良反應])。
已知自殺行為預示著抑鬱症和其他某些精神疾病的風險,反之這些疾病本身也是自殺的高危因素。匯總分析短期、安慰劑對照試驗顯示治療抑鬱症和其他精神疾病時,抗抑鬱藥物(SSRIs和其它)會增加兒童、青少年和青年(18-24歲)的自殺風險。短期的對照試驗研究未顯示在24歲以上的成人中使用抗抑鬱藥物,自殺的風險與安慰劑相比有所增加。
在65歲及以上的成人中使用抗抑鬱藥物,自殺的風險與安慰劑相比有所減少。
類似其它5-羥色胺能藥物,使用文拉法辛治療尤其是在合併使用其它作用於5-羥色胺遞質系統的藥物(包括SSRIs、SNRIs 和曲坦)、或可能損害5-羥色胺代謝的藥物(包括MAOIs,例如:亞甲藍)或抗精神病藥或其他多巴胺拮抗劑時,可能會發生潛在威脅生命的5-羥色胺綜合徵或神經阻滯劑惡性綜合徵(NMS)樣反應。5-羥色胺綜合徵可能包括精神狀態改變(例如:激越、幻覺和昏迷)、自主神經不穩定(例如:心動過速、血壓不穩和高熱)、神經肌肉失常(例如:反射亢進、平衡失調)和/或胃腸道反應(例如:噁心、嘔吐和腹瀉)。5-羥色胺綜合徵最嚴重的表現形式和NMS 相似,包括高熱、肌僵硬、伴有可能生命體徵快速波動的自主神經不穩定和精神狀態改變。(見[藥物相互作用] -5-羥色胺綜合徵)。
如果臨床上有合理需要,要合併使用文拉法辛和其他能影響5-羥色胺能和/或多巴胺能神經遞質系統的藥物,建議仔細觀察病人,尤其在治療初始和劑量增加階段。
不建議合併使用文拉法辛和5-羥色胺前體(如:色氨酸補充劑)。
與單胺氧化酶抑制劑(MAOIs)潛在的相互作用如果停用MAOIs 不久後開始文拉法辛治療,或停用文拉法辛不久就開始MAOIs 治療,可能會發生不良反應、有時甚至是嚴重不良反應。這些不良反應包括震顫、肌痙攣、多汗、噁心、嘔吐、潮紅、頭暈、伴有類似於惡性綜合徵的高熱、癲癇發作、以至死亡。
已有關於藥理作用類似於怡諾思緩釋膠囊的其它抗抑鬱藥合併MAOIs 產生嚴重、甚至致死性的不良反應報告。如MAOIs 合併SSRIs 類藥物,這些不良反應還包括:高熱、強直、肌痙攣和生命體徵不穩定、精神狀態的改變(包括極度的激越,逐漸進展為譫妄和昏迷)。有報告在三環類抗抑鬱藥(TCAs)合併MAOIs 治療的一些病例中出現惡性綜合徵(嚴重高熱、癲癇發作),有時可以致命。在停用TCAs 後很快使用MAOIs 治療的患者中也有類似報告。尚無合併使用文拉法辛和MAOIs 的人體和動物研究,因為文拉法辛同時抑制是去甲腎上腺素和5-HT 的再攝取,因此怡諾思緩釋膠囊不能與MAOIs 同時服用,在至少停用MAOIs 14 天后,才能使用本品,或者至少停用本品7 天后,才能使用MAOIs。
5-羥色胺綜合徵
使用怡諾思®緩釋膠囊治療時,可能發生一種潛在生命威脅的5-羥色胺綜合徵或者抗精神藥物惡性綜合徵(NMS)樣反應,尤其是在與以下藥物合併使用時:作用於5-羥色胺遞質系統的藥物(包括SSRIs、SNRIs和曲坦)和損害5-羥色胺代謝的藥物,(包括MAOIs,例如亞甲藍)或合併套用抗精神病藥物或其他多巴胺拮抗劑。5-羥色胺綜合徵可能包括精神狀態的改變(例如,激越、幻覺、昏迷)、自主神經不穩定(例如,心動過速、血壓不穩、高熱)、神經肌肉系統失調(例如,反射亢進、動作失調)和/或胃腸道症狀(例如,噁心、嘔吐、腹瀉)。最嚴重的5-羥色胺綜合徵與抗精神病藥物惡性綜合徵的表現相似,包括高熱、肌肉強直、自主神經不穩定可能伴有生命體徵的快速波動,以及精神狀態的改變。(見 [藥物相互作用] )。
禁止怡諾思®緩釋膠囊與MAIOs合用治療抑鬱症(見[禁忌]和[注意事項]-警告,與單胺氧化酶抑制劑(MAOIs)潛在的相互作用)。
如果臨床上有合理需要,要合併使用文拉法辛和某種SSRI、SNRI或5-羥色胺受體激動劑(曲坦),建議密切觀察患者情況,尤其在治療初期和增加劑量時(見[藥物相互作用])。
不推薦合併使用文拉法辛和5-羥色胺前體物質(如:色氨酸補充劑)(見[藥物相互作用])。
持續性高血壓
文拉法辛的治療與部分患者持續的血壓升高有關(定義為臥位舒張壓(SDBP)≥90mmHg,並且連續3次血壓監測高於基線血壓10 mmHg,見表2)。
在對符合持續性高血壓標準的服用怡諾思®(常釋)患者分析顯示,使用怡諾思®(常釋)發生持續性高血壓的發生率與劑量增加有關(見表3)。
為了充分評價在高劑量下的血壓持續性升高的發生率,進行了接受平均劑量大於300mg/天怡諾思®緩釋膠囊的研究,但病例數較少。
表2 .怡諾思®緩釋膠囊上市前根據不同的適應症劃分,發生臥位舒張壓(SDBP)持續升高的數目(%)
上市前怡諾思緩釋膠囊治療抑鬱症患者的研究中,有0.7% (5/705)的患者由於血壓的升高而中止治療,其中大部分患者是中度的血壓升高(SDBP升高12到16 mm Hg)。在治療GAD的2項研究中,在8周或6個月的隨訪期內分別有0.7% (10/1381)和1.3% (7/535)的患者由於血壓的升高而中止,其中大部分患者是中度的血壓升高(8周時SDBP升高12到25 mmHg,6個月時升高8到28 mm Hg)。
持續的SDBP升高會產生不利的後果,在上市後的研究中,有報告需要立刻治療的高血壓發生,在使用文拉法辛進行治療前,必須對已有的高血壓進行控制。推薦在使用怡諾思緩釋膠囊治療的患者中應定期監測血壓。對於使用文拉法辛治療後出現持續性血壓升高的患者,應考慮減藥或停止治療。
收縮壓和舒張壓升高
在安慰劑對照的上市前研究中,平均血壓的變化見表4 仰臥位收縮壓和舒張壓的平均變化。在不同的適應症間,在怡諾思®緩釋膠囊治療的患者中證實仰臥位收縮和舒張壓與劑量的增加相關。
表4. 安慰劑對照臨床試驗中,不同適應症、試驗持續時間和劑量組的仰臥位收縮壓和舒張壓與基線相比的平均變化
在抑鬱症和廣泛性焦慮症的所有臨床試驗間,接受怡諾思®緩釋膠囊治療的患者仰臥位舒張壓升高≥15 mmHg的占1.4%(舒張壓≥105 mmHg),而安慰劑為0.9%。同樣的接受怡諾思®緩釋膠囊治療的患者仰臥位收縮壓升高≥20 mmHg的占1%(收縮壓≥180mmHg),而安慰劑為0.3%。
瞳孔擴大
有患者出現瞳孔擴大現象,可能與文拉法辛的治療有關。因此對有眼壓增高或者急性窄角型青光眼(閉角型青光眼)的患者應密切監測。
骨折
流行病學研究顯示套用五羥色胺再攝取抑制劑(SRIs)包括文拉法辛治療的患者骨折風險增加。但骨折風險的機制尚不明確。
一般注意事項:
停用怡諾思緩釋膠囊
對於使用文拉法辛治療的患者停藥時應系統評估其停藥症狀,包括文拉法辛治療GAD的臨床研究的前瞻性分析和治療抑鬱症的回顧性調查的結果。當患者突然的停藥或高劑量藥物減少時會出現一些新的症狀,出現的頻率隨著藥物的劑量和治療時間的增加而增高。
報告的症狀包括:激越、厭食、焦慮、意識模糊、協調和平衡障礙、腹瀉、頭暈、口乾、情緒煩躁、肌束震顫、疲勞、頭痛、輕躁狂、失眠、噁心、神經質、惡夢、感覺異常(電擊樣感覺)、嗜睡、出汗、震顫、眩暈和嘔吐。
在怡諾思緩釋膠囊、其它SNRIs和SSRIs上市後陸續有一些停藥後不良事件自發的報告,尤其在突然停藥時常可見:情緒煩躁、易激惹、激越、頭暈、感覺異常(如電擊感)、焦慮、意識模糊、頭痛、昏睡、情緒不穩定、失眠、輕躁狂、耳鳴和癲癇發作等。
以上表現一般為自限性,也有嚴重停藥反應的報告。
當患者停用怡諾思緩釋膠囊時,應注意監測這些可能出現的停藥症狀。推薦任一劑型的文拉法辛均應逐漸減量,避免突然停藥,並且對患者進行監控。如果在減藥和停藥過程中出現難以耐受的症狀時,可以考慮恢復至先前治療劑量,隨後醫生再以更慢的速度減藥(見[用法用量])。
失眠和神經質
在怡諾思緩釋膠囊短期治療抑鬱症和GAD時,與安慰劑相比,常引起失眠和神經質。見表5。
表 5. 治療抑鬱症和GAD的安慰劑對照研究中失眠和神經質的發生率
在使用怡諾思緩釋膠囊治療抑鬱症時,患者分別由於失眠和神經質導致停藥的發生率均為0.9%。
在怡諾思緩釋膠囊治療GAD的研究中,在治療8周以上的患者中由於失眠和神經質導致停藥的發生率分別為3%和2%,在治療6個月以上的患者中分別為2%和0.7%。
體重的變化
成年患者:臨床研究顯示有7%接受怡諾思緩釋膠囊和2%接受安慰劑治療的抑鬱症患者體重下降超過5%。因為體重下降而停藥的患者比例為0.1%。在與安慰劑對照治療GAD的研究中,6個月後怡諾思緩釋膠囊組和安慰劑組分別有3%和1%的患者體重下降超過7%。隨訪至8周時有0.3%服用怡諾思緩釋膠囊的GAD患者因為體重下降停藥。
文拉法辛合併減肥藥(如芬特明)的療效和安全性尚未明確,建議不合併使用文拉法辛和減肥藥。文拉法辛也未批准單獨或合併用於降低體重的治療。
兒童患者:兒童患者接受怡諾思緩釋膠囊治療有體重下降的報告。對於4項怡諾思緩釋膠囊雙盲、安慰劑對照可變劑量治療抑鬱症為期8周的臨床研究的匯總分析顯示,怡諾思緩釋膠囊治療的患者體重平均下降0.45kg(n=333),安慰劑組患者的體重下降為0.77kg(n=333)。在抑鬱症和GAD的患者的治療中,怡諾思緩釋膠囊與安慰劑相比有更多患者體重下降至少達到3.5%(怡諾思緩釋膠囊組的18%比安慰劑組的3.6%,p [0.001)。因治療而引起的厭食症狀對患者體重下降的影響可能更廣,難以評價(見[注意事項] - 食慾的變化)。
在一項開放的兒童和青少年接受怡諾思®緩釋膠囊6個月治療抑鬱症的研究中,評價藥物長期治療的風險。結果顯示,用怡諾思®緩釋膠囊的兒童和青少年體重的增加少於那些年齡和性別匹配的兒童和青少年的預期體重增加值。這種差異在兒童中([12歲)比在青少年中(]12歲)更為明顯。
身高的變化
兒童患者:在8周的安慰劑對照治療GAD的研究中,怡諾思緩釋膠囊治療的患者(年齡6~17歲)的身高平均增加0.3cm(n=132),安慰劑組平均增加1.0cm(n=132),p=0.041。這種身高增加的差異在低於12歲的患者中更為明顯。在為期8周安慰劑對照治療抑鬱症的研究中,怡諾思緩釋膠囊治療的患者的身高平均增加0.8cm (n=146),安慰劑組為0.7cm(n=147)。在1項6個月的抑鬱症開放研究中,接受治療的兒童和青少年身高增長,但低於其基於年齡和性別相匹配的預期值,年齡[12歲的兒童的這種實際身高與預期身高的差異更大。
食慾的變化
成年患者:通過對短程、雙盲和安慰劑對照治療抑鬱症的研究的匯總分析,怡諾思緩釋膠囊治療組比安慰劑組有更多的患者出現厭食,分別達到8%和4%。治療抑鬱症的過程中有1%的患者因為厭食停用怡諾思緩釋膠囊。通過對短程、雙盲和安慰劑對照治療GAD的研究的匯總分析,在怡諾思緩釋膠囊治療組比安慰劑組有更多的患者出現厭食,分別達到8%和2%,在8周的治療期內,有0.9%的GAD患者因為厭食停用怡諾思緩釋膠囊。
兒童患者:怡諾思緩釋膠囊和安慰劑對照治療的GAD抑鬱症的兒童患者中也出現厭食,有10%的年齡在6~17歲的患者服用怡諾思緩釋膠囊過程出現厭食,安慰劑組為3%。沒有患者因為厭食和體重下降而停用怡諾思緩釋膠囊。
誘發躁狂/輕躁狂
上市前的臨床研究顯示:用於治療抑鬱症時,有0.3%的服用怡諾思緩釋膠囊的患者出現躁狂或輕躁狂,安慰劑組為0%;用於治療GAD時,服用怡諾思緩釋膠囊的患者無一出現躁狂或輕躁狂,安慰劑組躁狂或輕躁狂發生率為0.2%。在所有的怡諾思(常釋)治療抑鬱症的研究中,服用文拉法辛的患者中有0.5%發生躁狂或輕躁狂,而安慰劑組卻未發生。據報告已上市的抗抑鬱藥物(包括文拉法辛)治療抑鬱症時也有少數的患者出現躁狂或輕躁狂。和所有的抗抑鬱藥物一樣,怡諾思緩釋膠囊慎用於有雙相情感障礙病史或家族史的患者。
攻擊性行為
較小比例的曾經接受抗抑鬱藥物治療(包括文拉法辛的治療,降低劑量和中斷治療)的患者可能發生攻擊性行為。與使用其它抗抑鬱藥物類似,對於具有攻擊性傾向病史的患者使用文拉法辛需要謹慎。
低鈉血症
通常在低血容量或者脫水患者中,使用SSRIs和SNRIs藥物包括文拉法辛時可能發生低鈉血症和/或抗利尿激素分泌異常綜合徵。老年患者、服用利尿劑的患者和由於其他原因導致的低血容量者,有較大的風險出現低鈉血症。在大多數情況下,低鈉血症是由於抗利尿素分泌異常綜合徵(SIADH)引起的。有病例報告血清鈉低於110mmol/L。對於出現低鈉血症症狀的患者應考慮停用怡諾思®緩釋膠囊,並且採取合適的醫學干預措施。
低鈉血症的症狀包括頭痛、思想集中困難、記憶損傷、意識模糊、虛弱、可能導致跌倒的搖擺不定。嚴重或急性的症狀包括幻覺、暈厥、癲癇發作、昏迷、呼吸停止和死亡。
驚厥
如同其它抗抑鬱藥,文拉法辛可能會引起驚厥。有驚厥史的患者應慎用。
癲癇發作在上市前的臨床研究中,所有的705例接受怡諾思緩釋膠囊治療的抑鬱症患者和1381例GAD患者中沒有出現癲癇發作。在所有的怡諾思®(常釋)上市前研究中,在接受不同劑量文拉法辛治療的患者中有0.3%(8/3082)出現癲癇發作。和其它抗抑鬱藥物一樣,怡諾思緩釋膠囊應慎用於有癲癇發作病史的患者,當患者癲癇發作時應停藥。
異常出血
SSRIs和SNRIs,包括怡諾思®緩釋膠囊,可能增加出血事件發生的風險。與阿司匹林、非甾體類的抗炎藥、華法令和其它抗凝藥合併使用可能會增加該風險。病例報告和流行病學研究(病例對照和組群設計)已經證明干擾5-羥色胺再攝取的藥物與胃腸道出血的相關性。與使用SSRIs和SNRIs藥物相關的出血事件包括瘀斑、血腫、鼻衄、瘀點和有生命危險的出血。
當怡諾思®緩釋膠囊與非甾體性抗炎藥、阿司匹林或其他任何影響凝血的藥合用時,患者應注意異常出血風險。
抑制5-羥色胺再攝取的藥物可導致血小板聚集的異常。服用文拉法辛的患者皮膚及黏膜出血,包括胃腸道出血的風險可能增加。因此,和其它5-羥色胺再攝取抑制劑一樣,有出血傾向的患者,包括使用抗凝藥及血小板抑制劑的患者應慎用文拉法辛。
血清膽固醇的升高
在為期3個月以上的安慰劑對照研究中,接受文拉法辛治療的患者中有5.3%出現有臨床意義的血清膽固醇的升高,安慰劑組為0%。在長期治療的患者中應監測血清膽固醇水平。
間質性肺病和嗜酸細胞性肺炎
與使用文拉法辛治療相關的間質性肺病和嗜酸細胞性肺炎鮮有報告。在有進行性呼吸困難、咳嗽或胸部不適症狀的文拉法辛使用患者應該考慮這些不良事件的可能性,應該對這些患者立刻進行醫學評估,並且考慮停止使用文拉法辛治療。
用於有伴發疾病的患者
在上市前,文拉法辛用於伴發軀體疾病患者的經驗有限。怡諾思緩釋膠囊用於伴有軀體疾病的患者可能會影響血液動力學和代謝,處方時需加以注意。
某些使用文拉法辛的患者據報告可發生劑量相關性的血壓升高。在上市後的臨床經驗中,有報告需要立即治療的血壓升高的病例。因此使用文拉法辛的患者建議監測血壓。在進行文拉法辛治療前,應該對先前存在的高血壓進行控制。那些原有基礎疾病會因血壓升高而惡化的患者應謹慎。
對於近期心肌梗塞或不穩定心臟疾病史的患者,尚缺乏套用文拉法辛的經驗,故難以進行評價。因此這些患者應慎用該藥。在上市前研究時有這些疾病的患者均已被剔除。在治療抑鬱症為期8~12周的雙盲、安慰劑對照的研究中,有275例服用怡諾思緩釋膠囊的患者和220例服用安慰劑的患者,在1項8周雙盲、安慰劑對照治療GAD的研究中服用怡諾思緩釋膠囊的610例患者和服用安慰劑的298例患者中,通過分析上述患者的心電圖,發現採用怡諾思緩釋膠囊治療和安慰劑組的抑鬱症患者QT間期(QTc)與基線相比有所延長(服用怡諾思緩釋膠囊者延長4.7msec,安慰劑組患者縮短1.9msec),採用怡諾思緩釋膠囊治療和安慰劑組GAD患者QT間期(QTc)與基線相比無明顯變化。
在這些研究中,對於抑鬱症的治療,接受怡諾思緩釋膠囊治療的患者的心率相對於基線的變化明顯高於安慰劑組(怡諾思緩釋膠囊組平均增加4次/分鐘,安慰劑組為1次/分鐘)。治療GAD的研究中,接受怡諾思緩釋膠囊治療的患者的心率相對於基線的變化明顯高於安慰劑組(怡諾思緩釋膠囊組平均增加3次/分鐘,安慰劑組無變化)。
在1項可變劑量的研究中,當怡諾思(常釋)的劑量達到200~375mg/天,平均劑量高於300mg/天時,服用怡諾思的患者的心率平均增加8.5次/分鐘,而安慰劑組平均增加1.7次/分鐘。
因為怡諾思有加快心率的可能,應注意可能由於心率增加會危及伴有潛在疾病(如甲狀腺功能亢進、心力衰竭或近期的心肌梗塞)的患者的安全,尤其在服用高劑量怡諾思情況下時。因此,對於可能由於心率加快而影響健康狀況的患者應慎用該藥。
在一項為期4-6周雙盲、安慰劑對照的臨床試驗中,對其中769例服用怡諾思(常釋)患者的心電圖評估顯示,試驗引起的傳導異常發生率與安慰劑相比沒有異常。
在腎功能不全(GFR = 10 到70 mL/min)和肝硬化的患者中,由於文拉法辛及其代謝產物的清除率減低,消除半衰期延長,因此應使用較小的劑量(見[用法用量]),怡諾思緩釋膠囊和其它抗抑鬱藥一樣,對這些患者應慎用。
靜坐不能/精神運動性不安
使用文拉法辛時可出現靜坐不能,其特徵表現為主觀性的、不愉快的或令人苦惱的坐立不安,需要來回走動,並且常常伴無法靜坐或安靜站立。可能發生於治療的前幾周內。
如果患者發生了這些症狀,增加劑量可能有害。
口乾
10%套用文拉法辛的患者報告口乾。這可能會增加齲齒風險,應建議患者注重口腔衛生。
糖尿病
糖尿病患者套用SSRI 或文拉法辛,可能會影響目前的血糖水平。所以,可能需要調整胰島素和/或其他抗糖尿病口服藥物的劑量。
患者用藥信息
醫生或其他醫療衛生專業人士應當告知患者、他們的家屬和他們的看護人有關使用怡諾思®緩釋膠囊治療的利益和風險,並且告知他們正確的用藥方法。
應建議患者關注以下內容,並要求他們在服用怡諾思®緩釋膠囊時出現這些情況時及時通知醫生。
臨床症狀的惡化及自殺風險:應當鼓勵患者、他們的家屬和他們的看護者警惕下列症狀的發生:焦慮、激越、驚恐發作、失眠、易激惹、敵意、攻擊性、衝動、靜坐不能(精神運動性不安)、輕躁狂、躁狂、其它行為異常變化、抑鬱症狀惡化、自殺意念、尤其是在使用抗抑鬱藥物治療的早期和增加或減少劑量時。由於這些變化可能是突發的,因此應當建議患者的家屬和看護人每天都查找這些症狀是否出現,應當向患者的醫生或醫療衛生專業人士報告這些症狀,尤其是出現嚴重的、突發的或不同於患者主訴的症狀。因為這些症狀可能增加自殺意念和行為的發生率,有密切監察和改變藥物治療的必要。
對認知和運動功能的妨礙
雖然文拉法辛不影響健康志願者的精神運動性、認知或複雜行為的執行能力,但是任何精神活性藥物可能損害判斷、思維和運動的執行能力。因此,在明確文拉法辛不會對他們這些能力帶來負面影響前,患者在駕駛車輛和操縱危險的機器時應謹慎。
伴隨用藥
因為藥物之間有潛在相互作用的可能,建議患者正在或準備服用任何處方藥或非處方藥(包括草藥和營養補充劑)時通知醫生。
患者應該對怡諾思®緩釋膠囊合併下列藥物引起5-羥色胺綜合徵的風險保持謹慎,這些藥物包括曲坦、曲馬朵、色氨酸補充劑和其他5-羥色胺能的藥物(見[藥物相互作用])。
患者對於怡諾思®緩釋膠囊和非甾體性抗炎藥、阿司匹林、華法令或其他影響血小板凝集的藥物合用時應謹慎,因為這些藥物和影響5-羥色胺再攝取的精神治療藥物合用與出血風險增加相關(見[注意事項]-一般注意事項,異常出血)。
酒精
儘管文拉法辛不會增加酒精引起的精神和運動技能的損害,但建議患者服用文拉法辛時應戒酒。
過敏反應
建議當患者出現皮疹、蕁麻疹和與過敏有關的表現時通知他們的醫生。
妊娠
建議患者在治療期內懷孕或準備懷孕時通知她們的醫生。
哺乳
患者如果是母乳餵養嬰兒,應通知她們的醫生。
軀體和精神依賴
體外研究顯示文拉法辛對阿片受體、苯二氮艹卓受體、苯環己哌啶(PCP)受體和NMDA受體無親和力。文拉法辛對嚙齒類動物的中樞神經系統無興奮作用。在對靈長類動物的研究中,文拉法辛無明顯興奮性和鎮靜方面的濫用傾向。
文拉法辛停藥反應有所報告(見[用法用量])。
目前尚無文拉法辛是否存在潛在濫用的系統性臨床研究,其它一些臨床研究中未見覓藥行為。然而對於一個中樞神經系統(CNS)活性藥物而言,上市前臨床研究的經驗不能預示藥物上市後有無誤用和/或濫用的可能。故醫生應仔細評估和密切隨訪有藥物濫用史的患者,以及時發現他們對文拉法辛的誤用或濫用(如:耐受性增強、藥物的加量和覓藥行為)。




孕婦及哺乳期婦女用藥
妊娠
孕婦使用文拉法辛緩釋膠囊的安全性尚未建立。如果在治療期間發生懷孕或計畫懷孕,應告知醫師。僅當使用文拉法辛的益處確大於可能的風險時方可使用本品。如果文拉法辛一直用至分娩或分娩前,應考慮到新生兒出現的停藥反應。某些第7至第9孕月以後暴露於文拉法辛的新生兒已有需要鼻飼、呼吸支持或延長住院的併發症的發生。這些併發症會在新生兒出生後立即發生。
流行病學資料提示,妊娠期使用SSRIs,尤其是在妊娠後期,可增加新生兒持續性肺高壓(PPHN)的風險。儘管尚無研究探索PPHN與SNRI治療的相關性,但是考慮到文法拉辛的相關作用機制(抑制5-羥色胺的重吸收),不能排除文法拉辛的該潛在風險。
如果母親在妊娠後期使用了SSRI/SNRI,新生兒可發生下列症狀:易激惹、震顫、張力減低、持續哭鬧和吸吮及睡眠困難。這些症狀可能是因5-羥色胺能效應或暴露症狀所致。在大多數情況下,這些併發症在分娩後立即出現或在分娩後24小時內出現。
致畸作用
給大鼠和家兔投予怡諾思®,劑量(以mg/m2換算)相當於人類最大推薦劑量的2.5倍(大鼠)和4倍(家兔),文拉法辛沒有致畸作用。然而如果在妊娠期開始使用文拉法辛直到仔鼠斷奶,當藥物劑量相當於人類最大推薦劑量的2.5倍時就會使大鼠仔鼠的體重下降,死胎的機會增多,同時在出生的最初5天仔鼠的死亡率也上升,死亡率上升的原因不明。當文拉法辛的劑量相當於人類最大推薦劑量的1/4時不會引起仔鼠死亡率的增加。在孕婦中目前尚無適當和對照良好的研究。因為動物的生殖研究的結果不一定預示人體的反應。故除非必須,否則文拉法辛不套用於孕婦。
非致畸作用
妊娠後3個月的胎兒暴露在怡諾思®緩釋膠囊、其它SNRIs(5-HT和去甲腎上腺素再攝取抑制劑)或SSRIs治療的環境下,分娩後住院時間延長、呼吸支持和胃管餵養的併發症增多。報告的臨床表現還包括呼吸窘迫、紫紺、肌張力增高/降低、體溫不穩定、餵養困難、嘔吐、低血糖、反射亢進、震顫、易激惹和哭泣不止等。這些表現與SSRIs和SNRIs的直接毒性作用相似,也可能是一種停藥綜合徵。需要注意的是部分患者的臨床表現與5-HT綜合徵相似(見[藥物相互作用] - 中樞神經系統活性藥物)。當給孕期後3個月的孕婦使用怡諾思®緩釋膠囊時,醫生應仔細權衡治療的利弊(見[用法用量])。
產程和分娩
文拉法辛對於人類產程和分娩過程的作用不明。
哺乳婦女
報告文拉法辛和ODV 可由母乳分泌。曾有上市後報告稱母乳餵養嬰兒易哭、易激惹和睡眠節律異常。停止母乳餵養後也報告與文法拉辛停藥後相一致的症狀。因為怡諾思®緩釋膠囊對餵養的胎兒有潛在嚴重不良反應的可能,必須考慮母親用藥的必要性,並在停止哺乳和停藥之間作出選擇。
孕婦使用文拉法辛緩釋膠囊的安全性尚未建立。如果在治療期間發生懷孕或計畫懷孕,應告知醫師。僅當使用文拉法辛的益處確大於可能的風險時方可使用本品。如果文拉法辛一直用至分娩或分娩前,應考慮到新生兒出現的停藥反應。某些第7至第9孕月以後暴露於文拉法辛的新生兒已有需要鼻飼、呼吸支持或延長住院的併發症的發生。這些併發症會在新生兒出生後立即發生。
流行病學資料提示,妊娠期使用SSRIs,尤其是在妊娠後期,可增加新生兒持續性肺高壓(PPHN)的風險。儘管尚無研究探索PPHN與SNRI治療的相關性,但是考慮到文法拉辛的相關作用機制(抑制5-羥色胺的重吸收),不能排除文法拉辛的該潛在風險。
如果母親在妊娠後期使用了SSRI/SNRI,新生兒可發生下列症狀:易激惹、震顫、張力減低、持續哭鬧和吸吮及睡眠困難。這些症狀可能是因5-羥色胺能效應或暴露症狀所致。在大多數情況下,這些併發症在分娩後立即出現或在分娩後24小時內出現。
致畸作用
給大鼠和家兔投予怡諾思®,劑量(以mg/m2換算)相當於人類最大推薦劑量的2.5倍(大鼠)和4倍(家兔),文拉法辛沒有致畸作用。然而如果在妊娠期開始使用文拉法辛直到仔鼠斷奶,當藥物劑量相當於人類最大推薦劑量的2.5倍時就會使大鼠仔鼠的體重下降,死胎的機會增多,同時在出生的最初5天仔鼠的死亡率也上升,死亡率上升的原因不明。當文拉法辛的劑量相當於人類最大推薦劑量的1/4時不會引起仔鼠死亡率的增加。在孕婦中目前尚無適當和對照良好的研究。因為動物的生殖研究的結果不一定預示人體的反應。故除非必須,否則文拉法辛不套用於孕婦。
非致畸作用
妊娠後3個月的胎兒暴露在怡諾思®緩釋膠囊、其它SNRIs(5-HT和去甲腎上腺素再攝取抑制劑)或SSRIs治療的環境下,分娩後住院時間延長、呼吸支持和胃管餵養的併發症增多。報告的臨床表現還包括呼吸窘迫、紫紺、肌張力增高/降低、體溫不穩定、餵養困難、嘔吐、低血糖、反射亢進、震顫、易激惹和哭泣不止等。這些表現與SSRIs和SNRIs的直接毒性作用相似,也可能是一種停藥綜合徵。需要注意的是部分患者的臨床表現與5-HT綜合徵相似(見[藥物相互作用] - 中樞神經系統活性藥物)。當給孕期後3個月的孕婦使用怡諾思®緩釋膠囊時,醫生應仔細權衡治療的利弊(見[用法用量])。
產程和分娩
文拉法辛對於人類產程和分娩過程的作用不明。
哺乳婦女
報告文拉法辛和ODV 可由母乳分泌。曾有上市後報告稱母乳餵養嬰兒易哭、易激惹和睡眠節律異常。停止母乳餵養後也報告與文法拉辛停藥後相一致的症狀。因為怡諾思®緩釋膠囊對餵養的胎兒有潛在嚴重不良反應的可能,必須考慮母親用藥的必要性,並在停止哺乳和停藥之間作出選擇。
兒童用藥
怡諾思®緩釋膠囊不應使用於18歲以下的兒童和青少年。怡諾思®緩釋膠囊用於兒童(18歲以下)的療效和安全性尚未證實(見[注意事項] - 警告,臨床症狀的惡化和自殺風險)。儘管有2項安慰劑對照研究中的766例抑鬱症兒童和2項安慰劑對照研究中的793例兒童GAD患者使用怡諾思®緩釋膠囊,但以上數據尚不足以支持該藥適用於兒童患者。
在兒童的臨床試驗中,觀察到有自殺意念的不良反應發生。另外敵意和自傷的報告也增多,自傷尤見於抑鬱症患者。
儘管尚無研究直接評估怡諾思®緩釋膠囊對兒童和青少年生長、發育和成熟的影響,但先前的研究提示怡諾思®緩釋膠囊可能對身高和體重帶來負面的影響(見[注意事項] - 身高和體重的改變)。當決定給兒童患者使用怡諾思®緩釋膠囊,尤其是長期用藥時,建議定期監測身高和體重。對兒童患者連續使用怡諾思®緩釋膠囊治療超過6個月的安全性尚缺乏系統性地評估。
與成年患者相似,兒童和青少年患者(6~17歲)中觀察到食慾下降、體重減輕,血壓升高和膽固醇水平升高。如果兒童/青少年使用文拉法辛,建議定期測查體重和血壓。如果有持續血壓升高,應該停用文拉法辛,兒童/青少年長期套用文拉法辛,應測查血清膽固醇。故對成年患者的警示也適用於兒童患者。(見[注意事項] - 持續性高血壓和[注意事項] - 血清膽固醇升高)。
6歲以下兒童安全性尚未評估。
在兒童的臨床試驗中,觀察到有自殺意念的不良反應發生。另外敵意和自傷的報告也增多,自傷尤見於抑鬱症患者。
儘管尚無研究直接評估怡諾思®緩釋膠囊對兒童和青少年生長、發育和成熟的影響,但先前的研究提示怡諾思®緩釋膠囊可能對身高和體重帶來負面的影響(見[注意事項] - 身高和體重的改變)。當決定給兒童患者使用怡諾思®緩釋膠囊,尤其是長期用藥時,建議定期監測身高和體重。對兒童患者連續使用怡諾思®緩釋膠囊治療超過6個月的安全性尚缺乏系統性地評估。
與成年患者相似,兒童和青少年患者(6~17歲)中觀察到食慾下降、體重減輕,血壓升高和膽固醇水平升高。如果兒童/青少年使用文拉法辛,建議定期測查體重和血壓。如果有持續血壓升高,應該停用文拉法辛,兒童/青少年長期套用文拉法辛,應測查血清膽固醇。故對成年患者的警示也適用於兒童患者。(見[注意事項] - 持續性高血壓和[注意事項] - 血清膽固醇升高)。
6歲以下兒童安全性尚未評估。
老年用藥
大約分別有4%(14/357)和6%(77/1381)的參加上市前怡諾思®緩釋膠囊與安慰劑對照治療抑鬱症和GAD的患者的年齡高於65歲。參加怡諾思®(常釋)治療抑鬱症上市前研究的2897例患者中,12%(357)的患者年齡高於65歲。未發現老年患者與年輕患者在療效、安全性方面有根本的差異,在其它報告中,臨床療效方面也沒有差異。老年患者使用SSRIs、SNRIs包括怡諾思®緩釋膠囊與臨床上的低鈉血症的發生有關,並且發生該不良反應的風險更高(見[注意事項]- 一般注意事項,低鈉血症)。
老年患者的文拉法辛和ODV 的藥動學無本質的變化(見[藥代動力學])。無需根據患者的年齡調整藥物的劑量,當然在有其它常見於老年人的臨床狀況如腎功能或肝功能不全時,應適當減量(見[用法用量])。
老年患者的文拉法辛和ODV 的藥動學無本質的變化(見[藥代動力學])。無需根據患者的年齡調整藥物的劑量,當然在有其它常見於老年人的臨床狀況如腎功能或肝功能不全時,應適當減量(見[用法用量])。
研發歷程
1994年,EFEXOR速釋劑型被批准在美國上市。
1997年,EFEXOR XR問世並在美國上市。創新的緩釋技術不僅將每天只需服用一次藥物的理想變為現實,而且使活性成分的釋放更加平穩,從而降低了患者在服藥早期的一些不良反應發生率。
1999年,EFEXOR XR成為全球第一個被美國食品藥品監督管理局(FDA)批准廣泛性焦慮障礙(GAD)適應症的新型抗抑鬱藥。
2001年,EFEXOR XR正式進入中國,商品名為怡諾思,適用於治療各種類型抑鬱症(包括伴有焦慮的抑鬱症)及廣泛性焦慮症。
2007~2010(專利期滿)年間,EFEXOR XR是全球處方量第一的抗抑鬱藥。
2014年,EFEXOR研發團隊榮獲年度美國化學學會頒發的“化學英雄”獎。該獎項旨在表彰為改善人類健康、推動化學及化學工程創新發展做出突出貢獻的傑出科學家,代表了目前全球化學科學領域專業人才的最高水平。怡諾思成為第一個獲此殊榮的抗抑鬱藥。
貯藏
25°C 以下室溫、乾燥處保存。
包裝
75mg: 鋁塑包裝,75mg/粒,7 粒/板,2 板/盒。150mg: 鋁塑包裝,150mg/粒,7 粒/板,2 板/盒。

有效期
36 個月。
執行標準
進口藥品註冊標準:JX19990411
批准文號
進口藥品註冊標準:
75mg:H20110185;H20110186
150mg:H20110187;H20110188
分包裝批准文號:
75mg: 國藥準字J20120038
150mg: 國藥準字J20120039
75mg:H20110185;H20110186
150mg:H20110187;H20110188
分包裝批准文號:
75mg: 國藥準字J20120038
150mg: 國藥準字J20120039
生產企業
Pfizer Ireland Pharmaceuticals
包裝企業
愛爾蘭惠氏藥廠
核准日期
2006年10月23日
修訂日期
2007年2月20日 2008年8月20日 2009年2月20日 2010年5月21日 2011年4月01日 2011年7月14日 2011年8月19日 2011年11月05日 2012年04月01日 2012年05月23日 2012年08月02日
