在生物化學中,若已經有配體分子結合在一個高分子上,就是新的配體分子與這個高分子的結合作用就常常會被增強(亦被稱作協同結合)。以阿奇博爾德·希爾命名的希爾係數提供了量化這種效應的方法。
此方程描述了高分子被配體飽和的分數是一個關於配體濃度的函式;被用於確定受體結合到酶或受體上的契約性程度。此方程首次於1910年由阿奇博爾德·希爾闡釋出來以表述為何血紅蛋白的氧氣結合曲線會呈現S型。
當係數為1時,表明結合作用是完全獨立的,而不取決於已經有多少配體已經結合上去。大於一的數表示正協同,而小於一的數表示負協同。希爾係數最初被設計出來是用於解釋氧氣協同地結合到血紅蛋白上的過程(此系統的希爾係數為2.8~3)。
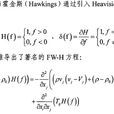
 公式推導
公式推導