基本介紹
- 中文名:多酸化學
- 英文名:polyoxometalates
- 化學式:Mo,W,V,Nb,Ta等
- 危險性符號:!
- 是什麼:前過渡元素
- 常見結構: Lindqvist 結構
- 多酸分類:2種
多酸簡介
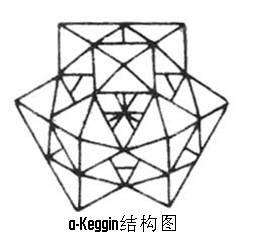


多酸化學是指一些(),以 MOx(x值一般為6)為單元通過共角、共邊(偶爾共面)氧聯結縮聚成多金屬氧酸化合物,即多酸化合物,更廣義地稱為金屬-氧簇化合物(Metal...
《多酸化學概論》是東北師範大學出版社2009年7月出版的圖書,作者是王恩波。...... 《多酸化學概論》是東北師範大學出版社2009年7月出版的圖書,作者是王恩波。...
河南省多酸化學重點實驗室始建於1996年,2012年經科技廳批准立項建設省重點實驗室,2015年4月通過專家組驗收正式成立。經過多年的建設和凝練,實驗室已形成多酸合成...
《多酸基功能配合物》是2014年7月1日化學工業出版社出版的圖書,作者是王秀麗、田愛香。...
多酸科學教育部重點實驗室(東北師範大學)於2006年批准成立,該實驗室以多酸材料研究為特色,以豐產元素多酸合成化學、多酸藥物化學、多酸型功能材料與催化、多酸...
《多酸複合物的組裝化學及套用》根據多酸複合物的最新研究和發展動態,參考了國內外有關資料和大量的最新科研成果,從不同類型的多酸複合物的組裝,多酸複合物的電...
中文名稱茵多酸IUPAC7-oxabicyclo[2.2.1]heptane-2,3-dicarboxylic acidCAS名7-oxabicyclo[2.2.1]heptane-2,3-dicarboxylic acid分子式C8H10O5作用特性可...
·開封博凱農藥研究所、環境與分析科學研究所簡介、精細化學與工程研究所、理論化學研究所、河南省多酸化學重點實驗室、鉬鎢化學與化工河南省高校重點學科開放實驗室...
化學學院由化學系、套用化學系、多酸化學研究所、功能材料化學研究所、化學教育科學研究所、分析測試中心、化學基礎教學實驗中心、吉林省鋰離子電池材料科技創新中心、...
陳利娟,女,河南大學化學化工學院副教授,碩士研究生導師,主要從事於過渡金屬嵌入多鎢氧簇材料、稀土金屬嵌入多鎢氧簇材料、過渡-稀土異金屬多鎢氧簇衍生材料的設計...
無機雙螺旋類多酸配合物層出不窮,功能性多酸化合物的合成、開發依然是處使多酸化學長足發展的動力,多金屬氧酸鹽的功能化,幾乎涉及了所有領域,如催化、光電磁...
胡長文,北京理工大學化學學院院長,主要從事無機合成與超分子化學, 功能材料與納米化學, 多酸化學與綠色催化等研究。1996年獲國務院政府特殊津貼。2015年12月26日,...
王恩波,男,1934年出生,東北師範大學榮譽教授,校務委員會委員,長期從事我國豐產元素鎢鉬稀土雜多酸,雜多藍的性質及結構研究以及多酸型藥物化學和固體化學及納米材料的...
2002.1-2008.5在東北師範大學化學學院多酸化學研究所工作,先後任助教、講師。2008. 6加入蘇州大學功能納米與軟物質(材料)實驗室,被聘為教授,博士生導師。...
現任職於赤峰學院化學化工學院,主講無機化學和環境化學。[1] 郭樹榮科研著作 編輯 主編《環境化學》教材一部。主要從事多酸化學和無機材料化學研究,發表SCI收錄論文...
吳慶銀,男,1963年6月生,浙江大學化學系教授,博士生導師。中文名 吳慶銀 出生...無機固體材料化學; 無機合成與製備化學; 多酸化學與套用; 無機-有機雜化材料。...
