基因直接重組基因直接重組是細胞遺傳學科學家利用病毒作為載體攜帶外來基因送入已經高度分化的皮膚細胞內而直接參與基因重新編排的技術或方法。使用該基因重新編排技術可以誘導普通的皮膚細胞產生變化而轉化為帶有胚胎幹細胞性質的細胞。
基本介紹
- 中文名:基因重組
- 外文名:Gene recombination
基因直接重組(The gene reorganizes directly;direct reprogramming)。
基因直接重組是細胞遺傳學科學家利用病毒作為載體攜帶外來基因送入已經高度分化的皮膚細胞內而直接參與基因重新編排的技術或方法。使用該基因重新編排技術可以誘導普通的皮膚細胞產生變化而轉化為帶有胚胎幹細胞性質的細胞【也稱為誘導式多能性幹細胞(iPS)】。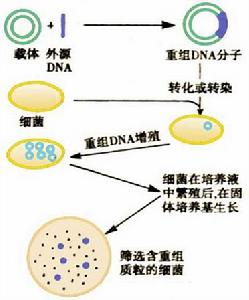 基因直接重組
基因直接重組
 基因直接重組
基因直接重組基因重組的概念比較寬泛,包括突變、自由組合都算在其內
基因直接重組法的發現和套用
兩本權威期刊《細胞》及《科學》在2007年11月20日同時刊出來自美國及日本兩個研究團隊的報告,證實皮膚細胞經過“基因直接重組”後可以轉化成為具有胚胎幹細胞特性的細胞。這項發現一方面解決了利用胚胎進行幹細胞研究的道德爭議,另一方面也使得幹細胞研究的來源更不受限。分屬京都大
學及威斯康辛大學麥迪遜分校的兩個團隊雖然獨立研究,但使用的方法幾乎完全相同,更巧合的是竟然同時分別被兩本期刊審核通過,證明基因直接重組技術的確有效。他們所使用的方式都是利用病毒將四個基因送入皮膚細胞,促使普通的皮膚細胞產生變化,最後成為帶有胚胎幹細胞性質的細胞,稱為誘導式多能性幹細胞(iPS )。
基因直接重組法成功誘導出幹細胞
美國和日本研究人員2007年11月20日分別宣布,成功把人體皮膚細胞改造成類似胚胎幹細胞的“萬能細胞”。
科學界評價這一突破為生物科學的“里程碑”,同時可能意味著風靡一時的胚胎幹細胞克隆技術退出舞台。 基因直接重組使幹細胞研究獲突破
基因直接重組使幹細胞研究獲突破
 基因直接重組使幹細胞研究獲突破
基因直接重組使幹細胞研究獲突破●同時發表
美日兩國研究小組20日分別在兩家權威科學雜誌發表相關研究報告。美國威斯康星大學詹姆斯·湯姆森實驗室的研究發表在《科學》雜誌,而日本京都大學教授山中伸彌領導的研究小組把報告發表在《細胞》雜誌。
兩個研究小組都利用了相同的技術—基因重新編排技術,藉助逆轉錄酶病毒為載體向皮膚細胞中植入一組4個基因,通過基因重新編排,使皮膚細胞具備胚胎幹細胞的功能。這種被改造過的細胞被稱作“iPS細胞”。
兩個研究小組選擇的植入基因組合略有不同,另外它們選用了不同類型的人體皮膚細胞為“底版”。美國研究小組選用的是成纖維細胞,而日本研究小組選擇的是面部皮膚細胞。實驗表明,“iPS細胞”與胚胎幹細胞功能十分相似,能夠最終培育成人體組織或器官。由於這種幹細胞能通過基因組合控制,因此有“萬能細胞”、“變色龍細胞”之稱。
2007年6月,美日三個研究小組曾宣布成功地把老鼠皮膚細胞改造成類似胚胎幹細胞的細胞。科學家認為,將人體皮膚細胞改造成幾乎與胚胎幹細胞具有同樣功能的幹細胞,意味著有關技術進一步成熟。
●高度評價
科學界對這一研究給予高度評價。因為這種被稱為“直接改造”的技術不僅能避免人體胚胎克隆技術引發的倫理爭議,其高效、便利也為進一步醫學套用打開了大門。
世界首隻克隆羊多利的“助產士”、英國科學家伊恩·威爾默特在一份聲明中說:“我們現在可以構想這么一個時代:能夠以一種簡單方式製造幹細胞,任何人身上的組織標本均能培育出任何組織器官。”
威爾默特數天前宣布,決定放棄“創造”多利羊的胚胎細胞克隆技術,轉向日本科學家提出的體細胞“直接改造”技術。
致力於人體胚胎克隆技術研究的美國細胞高級技術研究所首席科學家羅伯特·蘭扎也不惜溢美之辭:“這項研究是一個了不起的科學裡程碑。從生物學意義上講,相當於萊特兄弟製造的首架飛機。”
●潛在風險
據悉,這項技術尚不能完全取代胚胎細胞克隆技術,因為它現階段的實驗方式存在潛在副作用。
美日研究小組利用逆轉錄酶病毒“改造”皮膚細胞,這種病毒可能使基因產生變異,引發腫瘤等副作用。因此,在評估和克服這一潛在風險前,“萬能細胞”還不能用於器官移植等臨床套用。
另一種風險與倫理有關,儘管不像人體胚胎細胞克隆技術那樣容易引發爭議。山中伸彌說,套用這項技術,或許能通過皮膚細胞製造精子和卵子,這能幫助那些有生育問題的患者,“但為避免濫用,有必要在製造和利用人體萬能細胞方面作出適當規範”。
重組DNA技術的基本原理
DNA克隆過程包括:目的基因的獲取,基因載體的選擇與構建,目的基因與載體的拼接,重組DNA分子導人受體細胞,篩選並無性繁殖含重組分子的受體細胞(轉化子)。
目的基因的獲取常用的方法:化學合成法、基因組DNA文庫、cDNA文庫聚合酶鏈反應 ,克隆載體的選擇和構建:將外源DNA連到複製子上,外源DNA則可作為複製子的一部分在受體細胞中複製。這種複製子就是克隆載體。
外源基因與載體的連線:粘性末端連線包括同一限制酶切割位點連線和不同限制性內切酶位點連線;平端連線;同聚物加尾連線;人工接頭連線。
重組DNA導入受體菌:導入重組DNA分子的方法有轉化(transformation)、轉染(transfectim)和感染(infection)等。受體細胞為細菌時,常採用電穿擊法、熱擊法等。
重組體的篩選:根據載體體系、宿主細胞特性及外源基因在受體細胞表達情況不同,可採取直接選擇法和非直接選擇法。直接選擇法,指對載體攜帶某種或某些標誌基因和目的基因而設計的篩選方法,其特點是直接測定基因或基因表型;抗藥性標誌選擇,標誌補救,分子雜交法; 免疫學方法不是直接鑑定基因,而是利用特異抗體與目的基因表達產物相互作用進行篩選,因此屬非直接選擇法。免疫學方法特異性強、靈敏度高,尤其適用於選擇不為宿主菌提供任何選擇標誌的基因。免疫學方法又可根據具體基因選擇操作過程不同,分為免疫化學方法及酶免檢測分析等。
克隆基因的表達:目的基因的表達體系的建立包括表達載體的構建、受體細胞的建立及表達產物的分離、純化等技術和策略。表達體系包括原核表達體系和真核表達體系兩類。E. coli是當前採用最多的原核表達體系,其優點是培養方法單、迅速、經濟而又適合大規模生產工藝,人們運用E.coli表達外源基因已有20多年的經驗。在實際工作中,根據表達的基因不同,選擇不同的表達策略。E.coli表達體系在實際套用中尚有一些不足之處:①由於缺乏轉錄後加工機制;②由於缺乏適當的翻譯後加工機制;③表達的蛋白質常常形成不溶性的包涵體,欲使其具有活性尚需進行複雜的復性處理;④很難在Ecol表達體系表達大量的可溶性蛋白。真核表達體系如酵母、昆蟲及哺乳類動物細胞表達體系顯示了較大優越性。尤其是哺乳類動物細胞,不僅可表達克隆的cDNA,而且還可表達真核基因組DNA;哺乳類細胞表達的蛋白質通常總是被適當修飾,而且表達的蛋白質會恰當地分布在細胞內一定區域並積累。哺乳類動物細胞表達體系的缺點是操作技術難、費時、不經濟。常用於細胞轉染的方法有:磷酸鈣轉染、DEAE葡聚糖介導轉染、電穿孔、脂質體轉染及顯微注射等。當前採用最多的哺乳類細胞是COS細胞(猿個猴腎細胞)和CHO細胞(中國倉鼠卵巢細胞)。
