四氮化四硫(分子式:S4N4)是最重要的硫-氮二元化合物,室溫下為橙黃色的固體。它的結構和成鍵較特殊,也是製備其他含S-N鍵化合物時最主要的原料,因此成為化學家研究的焦點之一。
基本介紹
- 中文名:四氮化四硫
- 英文名:Tetrasulfur tetranitride
- 化學式:S4N4
- 分子量:184.292
- CAS登錄號:28950-34-7
- 外觀:橙黃色針狀結晶
基本簡介,結構性質,計算化學數據,物化性質,化學反應,保持環系,不保持環系,
基本簡介
性狀:橙黃色針狀結晶。
溶解情況:不溶於水,溶於苯、氯仿、二硫化碳、二氧六環等有機溶劑。
密度(g/cm3):2.22。
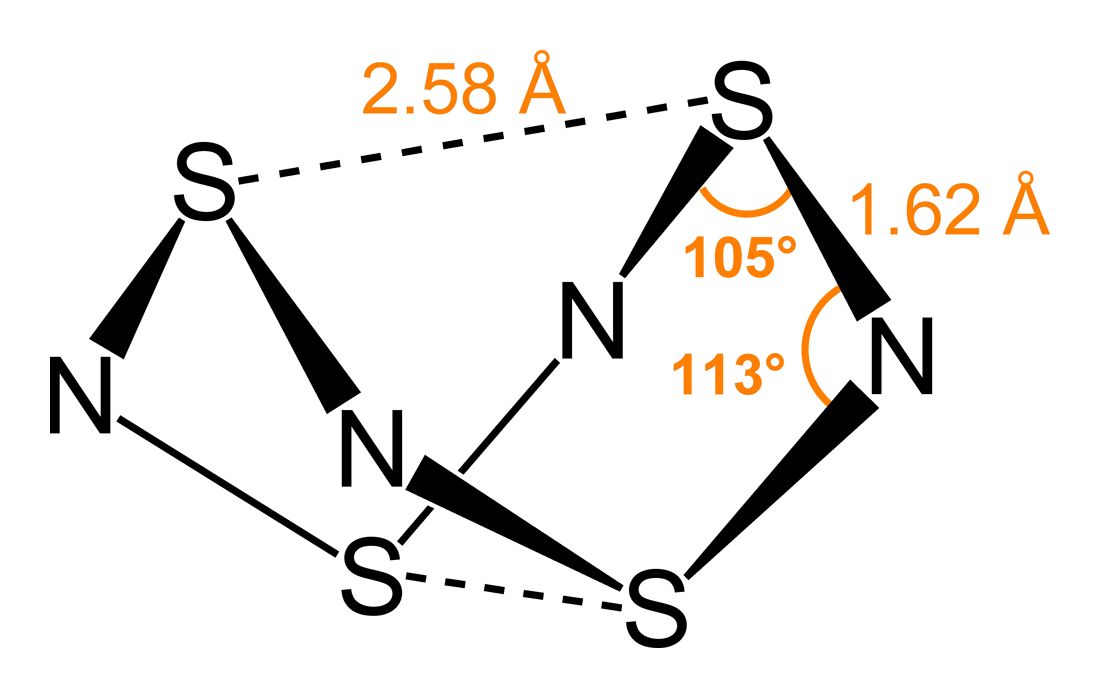
結構式:如概述圖。
結構性質
S4N4為雙楔形籠狀結構,具有D2d對稱。硫和氮交替構成一個假想的八元環,每一對硫原子中S-S相距2.586Å(由X單晶衍射測定)。同價的Se4N4結構類似。
四氮化四硫分子中,S-N鍵長几乎相等,存在電子離域。S-S“跨環”相互作用的距離要比范德華力的距離小得多,這個現象可以用分子軌道理論來解釋,但其實際原因仍然有爭議。1970年時Gleiter提出了一個目前接受得比較廣的理論:從分子對稱性上看,S4N4若為D4h的平面型結構,那么它將成為一個12π的平面體系,基態為三線態,會受到姜-泰勒效應的影響而發生構型扭曲。將其構型畸變為非平面的D2d型結構後,a2uLUMO和eg HOMO的順序交換,基態時變為單線態,能量降低,而且分子中也可以產生硫-硫跨環作用加以穩定,因此是有利的一個構型。
計算化學數據
1、疏水參數計算參考值(XlogP):4.3
2、氫鍵供體數量:0
3、氫鍵受體數量:8
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:102
7、重原子數量:8
8、表面電荷:0
9、複雜度:106
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:1
物化性質
S4N4生成熱為正值(460kJ/mol),屬於所謂“吸熱化合物”,在熱力學上不穩定。178~187℃熔化並分解,在130℃下的蒸氣壓為133.3帕。常壓下,高於130℃分解為相應的單質;低於130~300℃分解為二氮化二硫。撞擊、研磨或迅速加熱均能引起爆炸。雖然它在常溫下還算穩定,但研磨、摩擦、撞擊、震動和迅速加熱時,四氮化四硫都會猛烈分解並引起爆炸,生成非常穩定的產物:
S4N4 → 2N2 + 0.5S8 越純的四氮化四硫爆炸性越強。熱力學不穩定而動力學穩定的分子中,大多數結構較為複雜,結構簡單的不多,而四氮化四硫即是一例。
四氮化四硫為熱色性固體,具有色溫效應,低於-30°C時為淡黃色,室溫下為橙黃色,高於100°C時為深紅色。
化學反應
四氮化四硫與其他化合物發生的一系列反應主要可分為兩類,一類是S4N4環系保持的反應,一類是環系被破壞的反應。大多數研究著重於與有機金屬化合物的反應。
保持環系
S4N4會與Vaska配合物([Ir(Cl)(CO)(PPh3)2])發生氧化加成反應,生成含六配位銥的配合物,其中S4N4中的兩個硫原子和一個氮原子作配位原子。蔡斯鹽也可與四氮化四硫發生類似反應,生成鉑(IV)的配合物。
不保持環系
S4N4與[Pd2Cl6]陰離子反應,S4N4環系打開,生成三個鈀配合物。
與碘化氫或氯化氫的反應也屬於這一類:
S4N4+ 12HI → 4S + 4NH3 + 6I2S4N4 + 4HCl → S4N3Cl + NH4Cl + Cl2