耗氧腐蝕簡介
以溶解在溶液中的氧分子的還原反應為陰極過程的腐蝕,稱為氧還原腐蝕(oxygen reduction corrosion)或耗(吸)氧腐蝕(oxygen consumlng corrosion)。和析氫腐蝕一樣,只有氧的電位比金屬陽極電位正時,才可能發生耗氧腐蝕。所以,發生耗氧腐蝕的必要條件是金屬的電位EM低於氧還原反應的電位EO2,即
EM<EO2
在中性和鹼性溶液中氧還原反應為
O2 +2H2O +4e —→4OH-
其平衡電位為
EO2 =EθO2/OH- +2.3RT/4Flg(PO2/[OH-]4)
25℃時,EθO2/OH- =0.401V(SHE),天然水中溶解氧的PO2 =0.21atm(0.21×1.013×105Pa),當溶液pH=7時
EO2 =0.401+0.059/4lg0.21/10-28 =0. 805V(SHE)
O2 +4H+ +4e—→2H2O
其平衡電位為
EO2 =EθO2/H2O +2.3RT/4Flg(PO2/[H+]4)
25℃時,EθO2/H2O=-1.229V,PO2 =0.21atm,所以,氧的平衡電位與溶液pH值的關係為
EO2 =1.229 -0.059pH
顯然,pH值越小,氧的平衡電位EO2就越高,金屬發生耗氧腐蝕的可能性就越大。
自然界中,溶液與大氣相通,溶液中有溶解氧。在中性溶液中氧的還原電位為0.805V,可見,只要金屬在溶液中的電位低於這一數值,就可能發生耗氧腐蝕。所以,許多金屬在中性或鹼性溶液中,在潮濕大氣、
淡水、海水、潮濕土壤中,都會發生耗氧腐蝕。甚至在酸性溶液中也會有部分耗氧腐蝕。顯然,就所研究的金屬腐蝕而言,各種可能的陰極去極化反應中,以氧的陰極還原過程最為重要,並且較為普遍。可見,與析氫腐蝕相比,耗氧腐蝕更具有普遍意義。
過程
耗氧腐蝕包括兩個基本的過程,氧向陰極輸送和氧離子化反應。
①氧向陰極輸送。
在溶液中氧的溶解度很少(一般情況下最高濃度為10-4mol·L-1),在腐蝕過程中溶解氧不斷的在金屬表面上被還原而消耗。大氣中的氧首先通過空氣-溶液界面進入溶液,依靠對流和擴散的方式通過溶液的主液層,然後以擴散的方式通過滯留層到達陰極表面,陰極表面的滯留層在液體靜止時厚度可達到1mm,有攪拌時厚度在0.02~0.1mm之間。氧在滯留層只能擴散,因此,通過滯留層是氧向陰極輸送的主要阻力。
②氧離子化反應。
氧離子化反應方程式如式1和式2所示。氧離子化過程有中間產物產生,是-個複雜的過程,過程究竟分幾個步驟,至今尚無統一說法。但根據實驗數據的分析可知,它包括下列步驟:
氧離子化總反應方程式為:
O2 +2H2O +4e —→4OH-
a.形成氧離子:O2 +e—→O2;
b.形成二氧化一氫:O2- +H+—→HO2;
c.形成二氧化一氫離子:HO2 +e—→HO2-;
d.形成過氧化氫:HO2 +H+ +e—→H2O2 ;
e.形成氫氧離子:H2O2 +2e—→2OH-。
氧去極化的陰極過程受到氧向陰極輸送和氧離子化反應兩個步驟的聯合控制,其中任何一一個環節都可能成為陰極過程的控制因素而直接影響腐蝕速度。因此,耗氧腐蝕的陰極極化曲線比較複雜,它明顯地分為電化學極化區域(塔非爾直線區)和濃差極化區域。
影響因素
(1)水中氧的濃度的影響。在發生耗氧腐蝕的條件下,氧濃度增加與腐蝕成正比。例如,給水的含氧量比凝結水的含氧量高,所以給水系統的腐蝕比凝結水系統嚴重。疏水系統中由於疏水箱一般不密閉,因此耗氧腐蝕比較嚴重。
(2)水的pH的影響。當水的pH值小於4時,主要是酸性腐蝕。耗氧腐蝕作用相對來說影響比較小。當水的pH值為4~9時,鋼腐蝕主要取決於氧濃度,隨氧濃度增大而增大,與水的pH值關係很小。當水的pH值為9~13範圍內,因鋼的表面能生成較完整的保護膜,抑制了耗氧腐蝕。當水的pH值大於13時,鋼的腐蝕產物為可溶性的鐵的含氧酸鹽,因而腐蝕速度急劇上升。
(3)水的溫度的影響。在密閉系統中,當氧的濃度一定時,水溫升高,鐵的溶解反應速度和氧的還原速度增加,所以腐蝕加速。在敞口系統中,隨溫度的升高,氧向鋼鐵表面的擴散速度增快,而氧的溶解度下降,實驗表明大約水溫為80℃時,耗氧腐蝕速度最快。在凝結水系統中,由於
凝汽器的除氣作用,水中溶氧較低,水溫也較低,所以耗氧腐蝕速度較小,但因凝結水系統中常有二氧化碳存在,pH值較低,同時存在酸性腐蝕而使腐蝕程度加深。
(4)水中離子成分的影響。水中不同離子對腐蝕速度的影響很大,有的離子能減緩腐蝕,有的會加劇腐蝕。一-般水中H
+、硫酸根離子、鹽酸根離子對鋼的腐蝕起加速作用,因它們能破壞鋼鐵表面的氧化物保護層。水中濃度不是很大時,能促進金屬表面保護膜的形成,因而能減輕腐蝕;而濃度過大時,則能破壞表面保護膜,使腐蝕加劇。
(5)水的流速的影響。一般情況下,水的流速增大,氧達到金屬表面的擴散速度增加,金屬表面的滯流液層也變薄,鋼鐵耗氧腐蝕速度加快;當水流速度增大到一定程度,且溶解氧量足夠時,金屬表面可生成氧化保護層;水速再增大時,水流可因沖刷而破壞保護層,促使耗氧腐蝕。
耗氧腐蝕的特點
耗氧腐蝕的特點由上述氧陰極反應極化曲線及氧本身的性質可知,耗氧腐蝕有以下特點:
(1)鋼鐵的耗氧腐蝕一般都由氧的濃度極化控制。
(2)金屬在含氧量高的溶液中,其腐蝕電位較在含氧量低的溶液中為正,其腐蝕速度也較快。
(3)若不同金屬在同一腐蝕介質中的耗氧腐蝕都為氧的濃度極化控制,則在一定的腐蝕電位範圍內,各金屬的腐蝕速度相同,不受陽極極化曲線的影響,如圖所示。例如一些不同型號的碳鋼在水中的全面腐蝕速度幾乎相等。
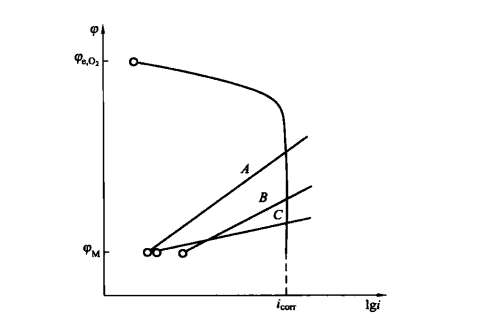 不同金屬在氧的濃度極化控制下的腐蝕速度
不同金屬在氧的濃度極化控制下的腐蝕速度(4)當金屬上已有一定數量的微陰極時,即使再增加微陰極的數量,對腐蝕速度也影響不大。溶氧向微陰極擴散的途徑猶如一個圓錐體。在微陰極達到一定數量時,溶液中的氧已全部擴散至金屬表面,因此再增加微陰極的數量時,也不會增加擴散的含氧量,所以對金屬的腐蝕速度影響不大。析氫腐蝕則不同,微陰極越多,腐蝕速度越快。
必須注意,如果是大陰極時,面積越大,擴散到陰極表面上氧的總量也越大,腐蝕電流也就增大。如陽極面積遠小於陰極面積,則陽極的腐蝕電流密度遠大於陰極電流密度,這樣局部腐蝕速度將受陽極極化曲線的影響。不同成分的鋼在水中發生點蝕、縫隙腐蝕和焊縫腐蝕等局部腐蝕的情況就是如此。
防止方法
要防止耗氧腐蝕,主要的方法是減少水中的溶解氧,或在一定條件下增加溶解氧。對於熱力發電廠,因為天然水中溶有氧氣,所以補給水中含有氧氣。汽輪機凝結水中也有氧,因為空氣可以從汽輪機低壓缸、凝結器、凝結水泵或其他處於真空狀態下運行的設備不嚴密處漏入凝結水。敝口的水箱、疏水系統和生產返回水中,也會溶人空氣。可見,給水中必然含有溶解氧。通常,我們用給水除氧的方法來防止鍋爐運行期間的耗氧腐蝕。
 不同金屬在氧的濃度極化控制下的腐蝕速度
不同金屬在氧的濃度極化控制下的腐蝕速度