吸入用異丙托溴銨溶液,作為支氣管擴張劑用於慢性阻塞性肺部疾病引起的支氣管痙攣的維持治療,包括慢性支氣管炎和肺氣腫。本品可與吸入性β受體激動劑合用於治療慢性阻塞性肺部疾病包括慢性支氣管炎和哮喘引起的急性支氣管痙攣。
基本介紹
- 藥品名稱:吸入用異丙托溴銨溶液
- 藥品類型:處方藥、醫保工傷用藥
- 用途分類:M受體阻斷藥
成份
化學名稱:(8γ)-3α-羥基-8-異丙基-1αH,5αH-溴化托品(±)-托品酸鹽一水合物(=異丙托溴銨一水合物)
化學結構式:
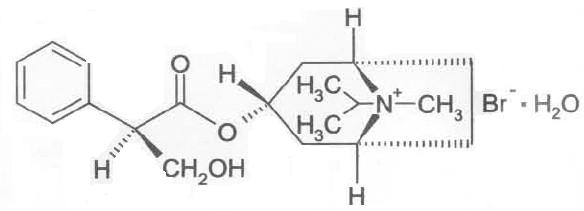
分子式:C20H30BrNO3·H2O
分子量:430.4
性狀
適應症
愛全樂可與吸入性β受體激動劑合用於治療慢性阻塞性肺部疾病包括慢性支氣管炎和哮喘引起的急性支氣管痙攣。
規格
用法用量
維持劑量:
成人(包括老人)和12歲以上青少年:
每天3-4次,每次1個單劑量小瓶。
急性發作治療:
成人(包括老人)和12歲以上青少年:
每次1個單劑量小瓶;病人病情穩定前可重複給藥。給藥間隔可由醫生決定。
愛全樂可與吸入性β受體激動劑聯合使用。
單劑量小瓶中每1毫升霧化吸入液可用生理鹽水稀釋至終體積2-4毫升或者可以和Berotec霧化吸入液聯合使用。
成人及12歲以上兒童日劑量超過2毫克應在醫療監護下給藥。
無論急性期治療或維持治療,建議都不要超過推薦劑量太多。
如果治療後未產生病情顯著的改善或病人情況更趨嚴重,必須尋求醫生的建議以決定新的治療方案。發生急性或迅速惡化的呼吸困難時應立即諮詢醫生。
愛全樂霧化吸入液可使用市面上一般的霧化吸入器。在有牆式給氧設施情況下,吸入液最好以每分鐘6-8升的流速給予。
吸入用異丙托溴銨溶液(愛全樂)可以和祛痰劑鹽酸氨溴索(沐舒坦)霧化吸入液、鹽酸溴己新(Bisolvon)霧化吸入液和非諾特羅(Berotec)霧化吸入液共同吸入使用。
由於可出現沉澱,愛全樂和含有防腐劑苯扎氯銨的色苷酸鈉霧化吸入液不要在同一霧化器中同時吸入使用。
使用方法:
單劑量霧化吸入液只能通過合適的霧化裝置吸入,不能口服或注射。
1.按生產廠商或醫生指導準備霧化器以加入霧化吸入液。
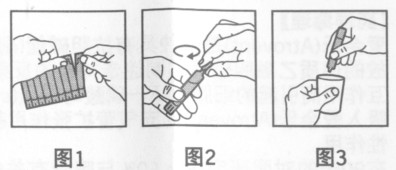
2.從生產條板上撕下一個單劑量小瓶。(見圖1)
3.用力扭頂部,打開小瓶。(見圖2)
4.將單劑量小瓶中的藥液擠入霧化器藥皿中。(見圖3)
5.安裝好霧化器,按說明使用。
6.按廠商的指示棄去霧化器藥皿中剩餘藥液並將霧化器清洗乾淨。
由於此單劑量小瓶中不含防腐劑,為防止細菌污染,在藥物打開後應立即使用且每次吸入治療時應使用一新的單劑量小瓶是非常重要的。部分使用後的、已開瓶的或有破損的藥瓶應丟棄。
不良反應
由於愛全樂(異丙托溴銨)腸道吸收較少,諸如心動過速、心悸、眼部調節障礙、胃腸動力障礙和尿瀦留等抗膽鹼能副作用少見並且可逆,但對已有尿道梗阻的病人其尿瀦留危險性增高。
眼部副作用已做報導(見[注意事項])。
和其它吸入性的支氣管擴張劑一樣,愛全樂可能引起咳嗽,局部刺激,極少情況下出現吸入刺激產生的支氣管收縮。
變態反應如皮疹、舌、唇、和面部血管性水腫、蕁麻疹、喉痙攣和過敏反應有報導。
禁忌
注意事項
有囊性纖維變性的病人更易於出現胃腸動力障礙。
使用愛全樂霧化吸入液後可能會立即出現過敏反應,極少病例報導出現蕁麻疹、血管性水腫、皮疹、支氣管痙攣和口咽部水腫及過敏反應等。
眼部併發症
當異丙托溴銨單獨或與腎上腺素β2受體激動劑合用,霧化液進入患者眼睛時,有個別報告眼部可出現併發症(如瞳孔散大、眼內壓增高、狹角性青光眼、眼痛)。
眼睛疼痛或不適,視物模糊,結膜和角膜充血所致的紅眼而視物有光暈或有色成像可能是急性狹角性青光眼的徵象。如果出現某些上述症狀,應首先使用縮瞳藥並立即求助醫生。
患者應在指導下正確使用愛全樂霧化吸入液。應注意避免藥液或氣霧進入眼睛。建議霧化吸入液通過口件吸入。如果得不到該裝置,可以使用合適的霧化面罩。特別提醒有青光眼傾向的患者應注意保護眼睛。
孕婦及哺乳期婦女用藥
目前尚不知愛全樂是否通過乳汁排泌。儘管非脂溶性的四價陽離子可進入乳汁,但愛全樂不太可能較大程度地進入嬰兒,特別是在吸入用藥時。儘管如此,由於許多藥物可通過乳汁排泌,因此對哺乳期婦女使用本品應特別慎重。
兒童用藥
老年用藥
藥物相互作用
當霧化吸入的異丙托溴銨和β激動劑合用時,有窄角型青光眼病史的病人可能增加急性青光眼發作的危險。
藥物過量
藥理毒理
吸入愛全樂(Atrovent)的支氣管擴張作用基本上是藥物在支氣管平滑肌局部所產生的抗膽鹼能作用,而非全身性作用。
在90天的對照研究中,40%與哮喘有關的支氣管痙攣的患者吸入愛全樂肺功能明顯改善(FEV1增加15%或15%以上)。
對慢性阻塞性肺部疾病(慢性支氣管炎和肺氣腫)引起支氣管痙攣的患者進行90天的觀察研究,治療後15分鐘即產生顯著的肺部功能改善(FEV1和FEF25-75%增長15%或15%以上),1-2小時後達到峰值,對大部分患者起持續作用可達6小時。
臨床前與臨床研究證實愛全樂(Atrovent)對氣道黏膜的分泌、纖毛的粘液清除作用或氣體交換均無不良作用。
對成人的研究證實了在治療哮喘導致的急性支氣管痙攣中愛全樂的支氣管擴張作用。在這些研究中愛全樂通常和吸入性β受體激動劑聯合使用。
對一些嚙齒類和非嚙齒類的動物進行了觀察期為14天的急性毒性試驗。
吸入給藥時,雌性豚鼠的最小致死劑量為199mg/kg,大鼠給予技術上可行的最高劑量時,未觀察到致死現象(0.05mg/kg,吸入4小時,或0.02mg/噴的愛全樂,給予160噴)。
口服和靜注的LD50的範圍為狗(靜注)LD5017.5mg/kg,小鼠(口服)LD50為2050mg/kg,與較高的靜注毒性相比,較低的口服毒性說明藥物胃腸道吸收較差。
長期服用的動物試驗分別在大鼠、家兔、狗和羅猴上進行。
對大鼠、狗和羅猴均進行了長達6個月的吸入研究,未見不良反應的劑量(NOAEL)分別為0.38mg/kg/天,0.18mg/kg/天和0.8 mg/kg/天。組織病理學檢查未發現支氣管、肺部系統出現與本品相關的病理損害。大鼠給藥18個月後口服的未見不良反應的劑量(NOAEL)為0.5mg/kg/天。
用新研發的一些劑型(滴鼻劑、HFA134a替代型推進劑)進行的長期吸入毒性研究中(大鼠持續6個月、狗持續3個月)未發現有關本品毒性的新信息。
在狗給予持續26周的滴鼻給藥研究中,未見不良反應的劑量(NOAEL)為]0.2mg/kg,與早期的持續13周的滴鼻給藥研究結果一致。
愛全樂的水溶液(0.05mg/kg,吸入4小時)經大鼠吸入使用的局部耐受性良好(急性毒性)。在長期毒性研究中,本品的局部耐受性也非常好。
豚鼠試驗既無主動過敏發應也無被動皮膚過敏反應發生。
體外細菌致突變試驗(Ames試驗)未顯示致突變性。體內試驗的結果(微核試驗、小鼠顯性致死試驗、中國倉鼠骨髓細胞的細胞質基因試驗)未顯示用藥後增加染色體的畸變率。
在小鼠和大鼠的長期試驗中未發現致瘤性或致癌性。
為研究愛全樂(Atrovent)對生育力、胚胎毒性和圍產期發育的影響,分別對小鼠、大鼠和家兔進行了試驗。
即使在能導致母體毒性、在某種程度上有胚胎毒性的最高劑量(大鼠1000mg/kg/天,家兔125 mg/kg/天),也不會引起後代產生畸形,且這些劑量已遠遠超過人的治療劑量。
吸入性氣霧劑技術性可行的最高劑量,大鼠1.5 mg/kg/天,家兔1.8mg/kg/天,對生殖無不良影響。
藥代動力學
吸入後,吸入劑量的10~30%(依賴於劑型和吸入技術)通常沉積在肺內。劑量的大部分被吞咽並經胃腸道排泄。
由於吞咽部分的生物利用度僅為2%左右,異丙托溴銨胃腸道吸收可以忽略。這部分藥物對活性成份的血漿濃度並無相應貢獻。沉積在肺內的部分迅速入血循環(數分鐘內),幾乎是全身生物利用度的全部。
異丙托溴銨全身生物利用度(肺和胃腸道)是吸入劑量的7~28%。這也是吸入溶液所吸入的有效劑量範圍。
沉積的異丙托溴銨動力學參數是通過靜脈注射後計算血漿濃度而得到的。
血漿濃度迅速的雙向減退被觀察到。表觀分布容積(Vz)為338 l(大約相當於4.6 l/kg)。
藥物與血漿蛋白有少量結合(小於20%)。基於分子的四價銨結構,異丙托溴銨離子不能通過血腦屏障。終末消除期的半衰期大約為1.6小時。
藥物平均總清除率為2.3 l/min。全身可利用劑量的60%主要從肝臟代謝降解排謝。腎臟的主要代謝藥物很難與M受體結合,所以是無活性的。
全身可利用劑量的40%主要從腎臟排泄,腎臟的排泄率為0.9L/分鐘。(而口服劑量的腎臟排泄只有1%,說明異丙托溴銨的胃腸道吸收很低)。
放射標記法測得i.v.給藥時,10%的藥物及代謝產物通過膽道-糞便途徑排泄。主要的標記性藥物經腎臟排泄。
