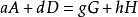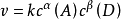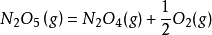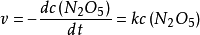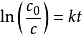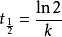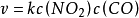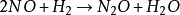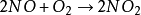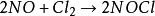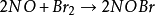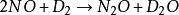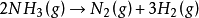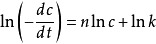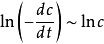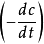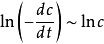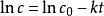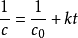定義
在化學反應的速率方程中,各物濃度項的指數之代數和就稱為該反應的級數(order of reaction),用n表示。
反應速率方程可表示為:反應速率
v速率等於速率常數
k與
反應物濃度的係數次方的乘積(與生成物無關)。

上式中:反應物濃度的次方為該反應物的
反應級數或分級數,如反應物A的級數是α,反應物D的級數是β,各反應級數的加和α+β就為該反應的反應級數。反應級數越大,表示濃度對
反應速率影響越大。
性質
一般而言,基元反應中反應物的級數與其計量係數一致;非基元反應則可能不同,其反應級數都是實驗測定的,而且可能因實驗條件改變而發生變化。例如,蔗糖的水解是二級反應,但是當反應體系中水的量很大時,反應前後體系中水的量可認為未改變,則此反應變現為一級反應。
在不同級數的速率方程中,速率常數k的單位不一樣,一般為Ln-1·mol1-n·s-1,n為反應的反應級數。
基元反應和簡單眼應的反應級數n可以是整數一、二、三級(只有少數反應為三級),而複雜反應的反應級數n也可以是分數、負數和零級(
光化反應、表面催化反應一般是零級)。負數級表示增加該物質的濃度反而使反應速率下降。但反應速率方程不具有簡單的濃度乘積形式者,反應級數的概念就失去了意義。
套用
一級反應
定義:凡是反應速率只與物質濃度的一次方成正比者,稱為一級反應(first order reaction)。
五氧化二氮的分解反應:
可以看出,此反應是一個一級反應。
對上式做定積分,
,式中c
0是初始濃度,c為反應到t時刻的濃度。
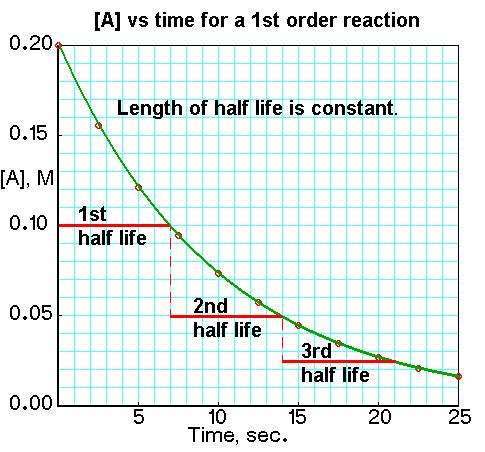
由此可知,當反應物消耗一半時,有
可以看出,一級反應的半衰期與反應的速率常數k成反比,而與反應物的起始濃度無關,這也是一級反應的一個特徵。
二級反應
定義:反應速率和物質濃度的二次方成正比者,稱為二級反應(second order reaction)。
故對CO是1級反應;對NO2是1級反應;該反應為2級反應。2級反應k 的量綱:mol-1·dm3·s-1。
三級反應
定義:反應速率和物質濃度的三次方成正比者,稱為三級反應(third order reaction)。
三級反應為數不多,在氣相反應中目前僅知有五個反應是屬於三級反應,而且都與NO有關。這五個反應是:兩個分子的NO和一個分子的Cl2,Br2,O2,H2,D2反應。即
零級反應
定義:反應速率與物質濃度無關者稱為零級反應(zeroth order reaction)。
反應總級數為零的反應並不多,已知的零級反應中最多的是表面催化反應。例如,氨在金屬鎢上的分解反應:
由於反應只在催化劑表面進行,反應速率只與表面狀態有關。若金屬表面已被吸附的NH3所飽和,再增加NH3的濃度對反應速率不再有影響,此時反應對NH3呈零級反應。
測定方法
在測定反應級數的實驗中,為了排除產物濃度的干擾,通常是測初速度。為了研究某一反應物濃度與反應速度的函式關係,常常將其他反應物的濃度固定後再確定該反應物的反應級數。
反應級數的測定方法包括兩類:積分法和微分法,前者包括嘗試法、作圖法和半衰期法,後者又包括孤立法。下面介紹作圖法和積分法兩種:
關於微分法。將速率方程取對數
,則
線性相關,斜率為
n。具體步驟為,在曲線上取若干個濃度點,並作切線。計算每點處切線的斜率
,作
的圖或線性回歸求出
n。
關於積分法。積分法是將c~t數據分別已知的動力學方程積分式中,如零級反應是
c=c0-kt,一級反應是
,二級反應
等,判斷何者更合適,這種方法需要逐個嘗試,計算量較大。