基本介紹
- 中文名:原子體積
- 外文名:atomic volume
- 釋義:原子量與固態時的密度之比
- 單位:立方厘米每摩爾原子
- 狀態:絕對零度和常壓
- 原子半徑:共價、范德華和金屬原子半徑
簡介

原子半徑
共價半徑

范德華半徑
金屬原子半徑

影響原子體積大小的因素







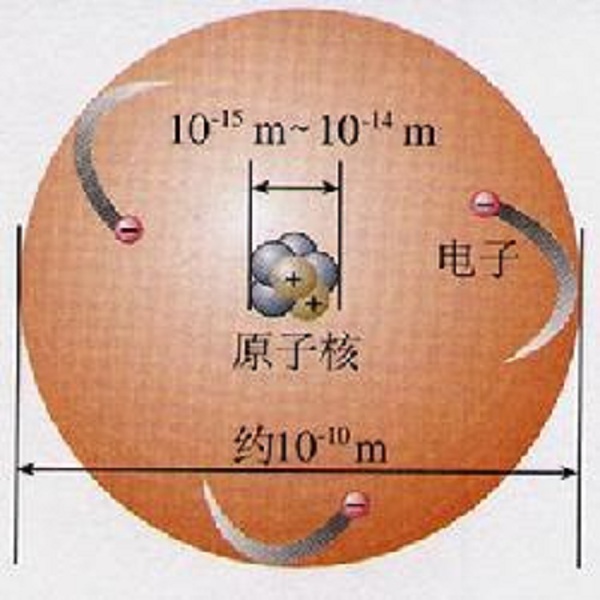











原子體積即原子的原子量與該元素在固態時的密度之比。原子體積是摩爾原子的體積,可由相對原子質量除以密度得到,其單位為立方厘米每摩爾原子。...
碳原子(carbon) 化學符號:C 元素原子量:12.011 質子數:6 原子序數:6 周期:2 族:IVA自然產生的碳由三種同位素組成:12C和13C為穩定同位素,而14C則具放射性。...
原子(atom)指化學反應不可再分的基本微粒,原子在化學反應中不可分割。但在物理狀態中可以分割。原子由原子核和繞核運動的電子組成。原子構成一般物質的最小單位,...
原子半徑(Atomic Radius)是描述原子大小的參數之一。根據不同的標度和測量方法,原子半徑的定義不同,常見的有軌道半徑,范德華半徑(也稱範式半徑),共價半徑,金屬...
對於一個原子來說,可分為原子核及核外電子。原子核只占原子內部極其微小的體積。核外電子由庫侖力提供向心力,以高速繞原子核做圓周運動。因此原子內部是極為空曠...
原子模型是人們對物質世界微觀結構的認識而建立的模型。目前人們普遍接受的原子模型為由原子核(質子和中子)和電子構成,電子繞核做不規則運動,形成的電子云模型。原子...
原子結構模型發展是指從1803年道爾頓提出的第一個原子結構模型開始,經過一代代科學家不斷地發現和提出新的原子結構模型的過程。...
原子論是指關於原子概念的學說。德謨克利特探討了物質結構的問題,提出了原子論的思想。他認為萬物的本原是原子和虛空。原子是一種最後的不可分割的物質微粒,它的...
體積模量是彈性模量的一種,它用來反映材料的巨觀特性,即物體的體應變與平均應力(某一點三個主應力的平均值)之間的關係的一個物理量。...
原子軌道又稱軌態,是以數學函式描述原子中電子似波行為。此波函式可用來計算在原子核外的特定空間中,找到原子中電子的幾率,並指出電子在三維空間中的可能位置。“...
在晶體學裡,原子堆積因子(或稱APF)是計算一個晶體的體積里原子體積占的比例的函式。在計算前,必須假定原子是堅硬的球體,而且有確定的表面(而不是含糊不清的電子...
原子(atom)指化學反應不可再分的基本微粒,原子在化學反應中不可分割。但在物理狀態中可以分割。原子由原子核和繞核運動的電子組成。原子構成一般物質的最小單位,...
釓(Gadolinium)是一種金屬元素,原子序數64,原子量157.25,呈銀白色,有延展性,熔點1313°C,沸點3266°C,密度7.9004克/厘米。元素名來源於研究鑭系元素有卓越貢獻...
原子體積(立方厘米/摩爾) 38.9 [1] 元素在海水中的含量:(ppm) 0.00008 [1] 地殼中含量(ppm) 0.00001 [1] 熔點 -156.6℃ [3] 沸點 -152.3...
