定義
中學
化合價表示原子之間互相化合時原子得失電子的數目。
化合價也是元素在形成化合物時表現出的一種性質。
元素在相互化合時,
反應物原子的個數比並不是一定的,而是根據原子的
最外層電子數決定的。比如,一個鈉離子(化合價為+1,失去一個電子)一定是和一個氯離子(化合價為-1,得到一個電子)結合。而一個鎂離子(化合價為+2,失去兩個電子)一定是和2個
氯離子結合。如果形成的化合物的離子的化合價代數和不為零,就不能使構成離子化合物的陰陽離子和構成
共價化合物分子的原子的最外電子層成為穩定結構。也就不能形成穩定的化合物。
化合價的概念就由此而來,那么元素的核外電子相互化合的數目,就決定了這種元素的化合價,化合價就是為了方便表示原子相互化合的數目而設定的。學習化合價時你應該了解化合物中元素化合價的規定。
另外,規定
單質分子裡,元素的化合價為
零,不論
離子化合物還是共價化合物,其組成的正、負離子的化合價的代數和均為零。離子化合物,例:NaOH(鈉化合價是正1價,
氫氧根離子化合價是負1價,相互抵消為
零價這樣的化合物
寫法就成立)
化合價——原子形成
化學鍵的能力。是形成穩定化合物中的彼此元素的化學性質。(即達成各元素形成穩定結構的一種能力性質)
注意:元素的“化合價”是元素的一種重要性質,這種性質只有跟其他元素相化合時才表現出來。就是說,當元素以
游離態存在時,即沒有跟其他元素相互結合成化合物時,因此單質元素的化合價為“0”。比如鐵等金屬單質、碳等非金屬單質、氦等稀有氣體。
大學
<大學裡化合價和中學的化合價定義不一樣,中學的化合價在大學被定義為
氧化數>
定義:某元素一個原子的表觀電荷數,這個電荷數是假設把每一個化學鍵中的電子指定給電負性更大的原子而求得的。
國際
1970年國際純化學和套用化學聯合會(IUPAC)較嚴格的定義了元素氧化數的概念:元素的氧化數(又稱氧化值)是某元素一個原子的荷電數,這種荷電數可由假設把每個鍵中的電子指定給電負性更大的原子而求得。
書寫
1.在化合物中,根據正負化合價代數和為零計算指定元素化合價。
2.在元素正上方明確標出元素化合價,一律標出正負號。
3.有氧元素出現時,氧元素寫在後面。
4.在由金屬和非金屬組成的化合物中,書寫化學式時,金屬元素的元素符號寫在前面,非金屬元素的元素符號寫在後面。
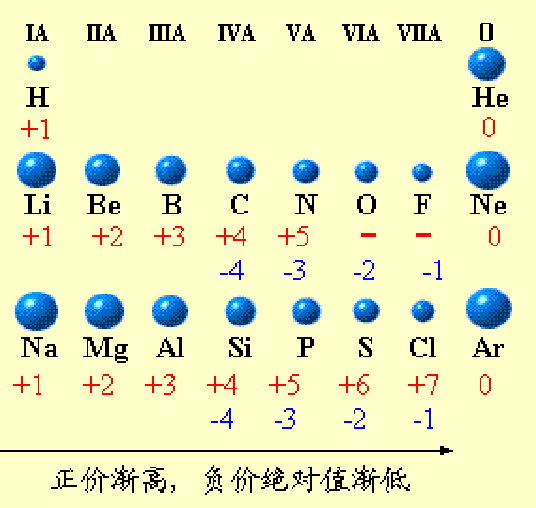
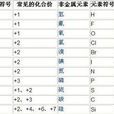
常見化合價
元素化合價
+1
H,Li,Na,K,Rb,Cs,Ag,Au,Hg,In,Tl,N
+2
Be,Mg,Ca,Sr,Ba,Cu,Ra,Zn,Cd,Hg,Cr,Mn,Fe,Co,Ni,C,Sn,Pb,N,S,O
+3
B,Al,Ga,In,Tl ,Sc,Y,La-Lu,N,P,As,Sb,Bi,Cr,Fe,Co,Ni,Au;Ce,Ac
+4
C,Si,Ge,Sn,Pb,Ti,Zr,Hf,Ce,Th,Mn,Tb,N,S
+5
N,P,As,Sb,Bi,V,Nb,Ta
+6
S,Se,Te,Cr,Mo,W,U,Mn,Fe
+7
Cl,Br,I,Mn,Tc,Re
+8
Xe,Ru,Os
-1
F,Cl,Br,I,O
-2
O,S,Se,Te
-3
N,P,As,Sb
(註:單質中原子的化合價都為0)
特殊原子團
亞硫酸氫根HSO3-:-1價
錳酸根MnO42-: -2價
乙酸根CH3COO-:-1價
磷酸二氫根H2PO4:-1價
(注意:
化學式相同,但不一定是同一個根,如錳酸根中錳呈+6價,
高錳酸根中錳呈+7價)
非金屬元素
由於金屬元素的原子最外層電子數大多都少於4個,故在
化學反應中易失去最外層電子而表現出正價,即金屬元素的化合價一般為正(極少數金屬能顯示負化合價,如銻,在銻化銦InSb中為-3化合價)。非金屬元素跟金屬元素相化合時,通常得電子,化合價為負。但是,當幾種非金屬元素化合時,
電負性較低的就會表現出正化合價。比如氧是電負性第二高的元素,通常顯示-2化合價。但當它遇到電負性最高的
氟元素時,就會顯示+2化合價,形成二氟化氧OF2。
 化合價
化合價計算規律
給了化合式之後,若知道一種元素的化合價,可將其化合價與其分子中該元素的原子數相乘。因化合價的電性為零,將零減去上一個化合價與該元素
原子數的積再除以分子中另一元素的原子數,即得到另一元素化合價。
給了兩元素的化合價,求出化合價的絕對值之最低公倍數。再用
最低公倍數除以化合價絕對值即求出分子中原子數。
化合價的表示方法:正負化合價用+1,+2,+3,-1,-2……0等要標在
元素符號的正上方。(如
)
確定化合物中元素的化合價,需注意
(1)化合價有正價和負價
(2)氧元素通常顯-2價。
(3)氫元素通常顯+1價。
(4)金屬元素跟非金屬元素化合時,金屬元素顯正價,非金屬元素顯負價(一般來說正價寫在前面,負價寫後面)。
(5)一些元素在同種物質中可顯不同的化合價。
(6)在化合物里正負化合價的代數和為0.
(7)元素的化合價是元素的原子在形成化合物時表現出來的一種性質,因此,在單質分子裡,元素的化合價為0.
化合價的求法
化合價是元素的一種性質,它只有在元素彼此化合時才表現出來。在化合物中正、負化合價代數和等於零,這是求化合價的準則。一般講,有下述幾種求法:
化學式或根式
1. 求AmBn化合物中A元素化合價的公式:
(B元素的化合價×B的原子個數)/A的原子個數
2. 求多元化合物中未知化合價的元素的化合價公式:
(已知化合價諸元素價數的代數和)/未知化合價的元素的原子個數
3.根據正、負電荷數判斷元素(或原子團)的化合價。
在根式中,正、負化合價總價數的代數和等於根式所帶的正、負電荷數。
練習1某鹽的
化學式(分子式)為Rm(SO4)n, 則R的化合價為多少?
由元素質量比
1.(A元素的相對原子質量×B元素的化合價)/(B元素的相對原子質量×元素的化合價)=A元素的質量比值/B元素的質量比值
2.A元素的質量比值(或百分組成)×A的化合價/A的相對原子質量=B元素的質量比值(或百分比組成)×B的化合價/B相對原子質量
練習2在氮和氧以7∶4質量比相結合的氧化物中,氮的化合價是幾?
由質量比
(B的化合價×A的相對
原子質量比值)/(A的化合價×B的相對原子質量比值)=A元素的質量比值/B元素的質量比值
練習3A、B元素相對原子質量之比為2∶1在僅有這兩種元素組成的化合物里,A、B元素的質量比為2∶3,其中B為負n價,則A在此化合物中的化合價是多少?
求化合價
1.若B為-2價,C為-1價,當A為奇數價時,則A價:
(2AC式量-AB式量)/(C式量×B價-B式量×A價)
2.若B為-2價,C為-1價,當A為偶數價時,則A價:
2(AC式量-AB式量)/(C式量×B價-B式量×A價)
3.若B、C價數相同,則A價為:(AC式量-AB式量)/(C式量-B式量)
確定方法
化學上用化合價來表示原子間相化合的數目。它是元素的一個重要性質,確定元素的化合價是國中生應掌握的一種基本技能,現就其在國中範圍內作一歸納,以期對同學們的學習有所幫助。
其他元素法
【例1】試確定化合物K2MnO4中Mn元素的化合價。
解析:設化合物中Mn元素化合價為+x價,依化合物中各元素化合價正負代數和為零的原則有2×(+1)+1×(+x)+4×(-2)=0解之得x=6
故K2MnO4中Mn元素化合價為+6價。
電子層結構法
【例2】元素X的原子最外層上有1個電子,元素Y的原子最外層上有6個電子,則X、Y兩元素可形成的化合物的化學式為[ ]
A.XY B.X2Y C.XY2 D.X3Y
解析:本題的關鍵可以說是首先得確定在形成化合物時,X、Y兩元素所表現的化合價。因X最外層上只有1個電子,最高正價為+1價,Y最外層6個電子,離8電子穩定結構尚差2個,故最低負價為-2價,則X、Y所形成化合物分子式為X2Y,應選B。
質量分數法
【例3】某元素的
相對原子質量為59,在其氧化物中該元素的質量分數為71%,則它的化合價為[ ]
A.+1 B.+2 C.+3 D.+4
解析:設該元素的氧化物化學式為RxOy
依題意有59x/(59x+16y)*100%=71%
解得 x/y=2:3
故化學式為R2O3,R化合價為+3價,選C。
質量守恆定律
【例4】某金屬氧化物與足量的鹽酸反應,生成的氯化物與水的分子數之比為2∶3,則該金屬的化合價是[ ]
A.+1B.+2C.+3D.+4
解析:設生成的氯化物化學式為RClx,依題意有分子數之比RClx∶H2O=2∶3根據
質量守恆定律可知,反應前後各元素的原子種類和數目不變,生成物中H、Cl的原子個數比也應為1:1,故x值為3,則R的化合價為+3價,選C。
相對分子質量
【例5】某金屬元素的氧化物相對分子質量為M,同價態的氯化物相對分子質量為N,則該元素的化合價數值為[ ]
解析:設該元素化合價為+x價,相對原子質量為MR
(1)如x為奇數時,氧化物化學式為R2Ox,氯化物化學式為RClx,據題意有
2MR+16x=M (1)
MR+35.5x=N (2)
(2)*2-(1)得x的值為
(2)x為偶數時,氧化物化學式為ROx/2氯化物化學式為RClx,據題意有
MR+35.5x=N ( 4 )
綜上討論,應選A、D。
質量關係法
【例6】相對原子質量為M的金屬單質ag與足量的稀硫酸反應,產生Bg氫氣,則反應中該金屬元素的化合價為[ ]
解析:設金屬在反應中化合價為+x價,則金屬
單質與生成H
2有如下關係:
2R~xH2
2M 2x
a b
故應選B。
相關因素討論
【例7】某元素M原子
最外層電子數少於5,其氧化物化學式為MxOy,氯化物化學式MClz當y∶z =1∶2時,M的化合價可能是[ ]
A.+1 B.+2 C.+3 D.+4
解析:M的化合價在數值上等於z的值
如y=1z=2 (合理)
y=2z= 4 (合理)
y=3z=6 (與最外層電子數少於5不符)
故應選B、D。
----------------------------------------------
 化合價
化合價
 化合價
化合價
