基本介紹
- 中文名:副反應
- 外文名:The side reaction
- 釋義:藥物在治療劑量下發生的
- 別名:副作用
[化學]

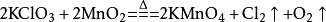



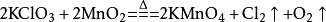


本書是第一部中西醫結合防治惡性腫瘤放化療毒副反應的專著,分為第一章總論、第二章各論和附錄三部分,重點闡述了放化療毒副反應的中西醫治療、10種常見腫瘤放...
由於選擇性低,藥理效應涉及多個器官,當某一效套用作治療目的時,其他效應就成為了副反應(通常也稱副作用)。副反應指一般會出現的反應,副作用常指藥物不利治病的一...
電池副反應是指電池中附加的多餘的反應,會導致充電效率降低以及容量、壽命損失或性能下降。...
《有機合成中的副反應》是2006年華東理工大學出版社出版的圖書,作者是(丹麥)多沃德。...
毒性反應指藥物劑量過大、用藥時間過長或藥物在體內蓄積過多時,對用藥者靶組織(器官)發生的危害性反應。...
醚化副反應 etherification side reaction廣義的醛化反應系指醇與醇間縮合一分子水生成醚的反應,在有機合成中常見。在化纖工業中常特指對苯二甲酸二甲酯(DMT)與...
藥品不良反應,是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應。... ●副作用(副反應):藥品按正常用法用量使用時所出現的與藥品的藥理學活性相關但與...
藥物不良反應在藥理學中,指某種藥物導致的軀體及心理副反應、毒性反應、變態反應等非治療所需的反應。可以是預期的毒副反應,也可以是無法預期的過敏性或特異性反應...
《癌症化學治療的毒副反應及其處理》是上海醫科大學出版社,復旦大學出版社出版的圖書,作者是邵永孚。...
《常見中草藥毒副反應與合理套用》是2007年廣東科技出版社出版的圖書,作者是賴祥林。...
《腫瘤放化療不良反應》是一部防治腫瘤放化療毒副反應的專著,由衛生部中日友好醫院腫瘤科編寫。主要內容包括腫瘤放化療毒副反應的臨床表現、發生機制、防治用藥規範、...
《西藥毒副反應的中醫治療》是現代袁世華等編著的一部臨證綜合類中醫著作。...... 《西藥毒副反應的中醫治療》是現代袁世華等編著的一部臨證綜合類中醫著作。...
(cationic polymerization )由陽離子引發而產生聚合的反應的總稱 特點 碳陽離子易發生和鹼性物質的結合、轉移、異構化等副反應——構成了陽離子聚合的特點; 引發過程...
國內近年來的研究重點在IUD出血副反應的產生機制,遠期安全性的研究。在防止IUD出血的新型IUD的研究方面,說明帶銅IUD上加入吲哚美辛能明顯減少置器後的出血,提高臨床...
2、補充植物活性硒不但可減少噁心、嘔吐、腸胃功能紊亂,食慾減退、嚴重脫髮等放化療時的毒副反應,還可減輕化療引起的白細胞的下降程度。 [3] 3、補充植物活性硒...
大部分化療的不良反應和毒副作用是可逆的,通過一些輔助藥物的使用可以控制或者減輕毒副作用。但化療畢竟是一種較為激烈的治療手段,因此,臨床醫生應該嚴格掌握化療適應...
1、肝臟的毒副反應:長期服用或過量服用均可引起肝細胞壞死。撲熱息痛引起肝細胞壞死是其直接對肝細胞的作用,可能是過量服用撲熱息痛致使體內生成一種毒性代謝產物...
這些副反應是數據只對年齡在75以下的病人適用。他達拉非禁忌 臨床研究表明他達拉非可以增強硝酸鹽類藥物的降壓作用。這被認為硝酸鹽類藥物和他達拉非共同作用於一...
