基本介紹
- 中文名:分裂能
- 外文名:splitting energy
- 表示符號: △
- 所屬類型:配位化合物
- 測定方法:光譜分析
- 涉及理論:晶體場理論
常見分裂,配合物分裂能,影響大小因素,常用測定方法,
常見分裂
中心離子d軌道的分裂
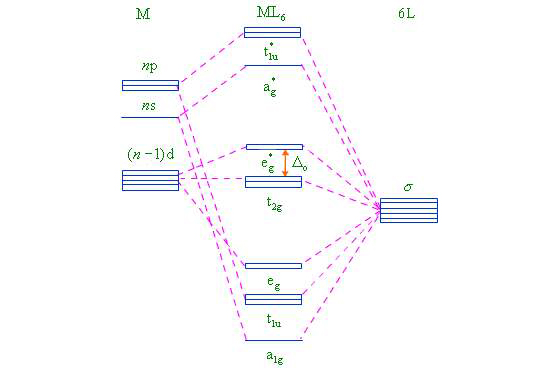
我們知道,各d軌道在窄問的伸展方向不同,但能量是相同的。在球形對稱的負靜電場作用下,這5個簡併d軌道的能量均會升高,由於受到的靜電排斥作用相等,所以能量升高也相等,因而不會產生分裂,如下圖1(a)(b)所示,但在配離子葉中,由於配體產生的電場不是球形對稱的,因而各d軌道受到的影響不同。現以6配位的八面體構型的配合物為例,當6個配體(負離子或NH3,H2O等極性分子的負端)沿著±x,±y,±z的方向接近中心離子時,配體便形成一個八面體場,如下圖2所示。
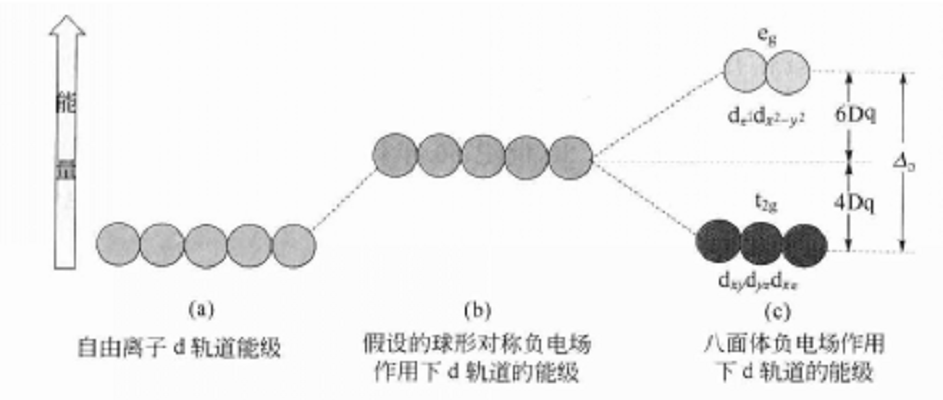 圖1 八面體場中d軌道的能級分裂
圖1 八面體場中d軌道的能級分裂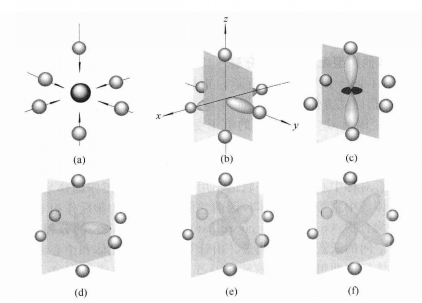 圖2 在八面體配合物中d軌道與配體的相對位置
圖2 在八面體配合物中d軌道與配體的相對位置在此八面體場中,中心離子的dz2和dx2-y2軌道正好與配體處於迎頭相撞,如上圖2(b)(c)所示,其電子云受到配體負電荷的排斥作用最大,因而這兩個軌道的能量比在球形對稱場中的能量要高,而dxy、dyz、dxz則恰巧處於配體的空隙之間,見上圖2(d)(e)(f),所以這三個軌道的電子云受到的排斥作用較小,比在球形對稱場中的能量要低,這樣便造成d軌道的分裂,如上圖1(c)所示。五個能量相等的d軌道分裂成兩組:一組是能量較高的dz2和dx2-y2,為二重簡併軌道(degenerate orbital),稱為dγ軌道: 另一組是能量較低的dxy、dyz、dxz,為三重簡併軌道,稱為dε軌道。
配合物分裂能
八面體配合物的分裂能
對八面體配合物(octahedral coordination compounds)的分裂能,用Δo表示,它相當於1個電子在dγ-dε間的躍遷所需要的能量。一般將Δo分成10等分,每等分為1Dq,則Δo為10Dq。量子力學指出,分裂前後d軌道的總能量應保持不變。若分裂前d軌道的能量作為零點,那么所有的dγ軌道和dε軌道的總能量等於零,即:
2Edγ+3Edε=0(有兩個軌道,有三個軌道),由於分裂能
Δo=Edγ-Edε=10Dq,所以解得:
Edγ=3/5Δo=6Dq(比分裂前高6Dq),
Edε=-2/5Δo=-4Dq(比分裂前低4Dq)。
影響大小因素
(1)配體的影響(△遞增次序)
同一中心離子,配體的場強越強,分裂能△越大。
光譜化學順序(從左到右配體的場強逐步增強):
I-< Br-< Cl-< F-< OH-< C2O42- < H2O < NH3 < en < NO2- <CN-(CO)
(2)中心離子的電荷數
中心離子電荷數越大,中心與配體距離越近,則作用越強,△越大。
如:Fe3+,△H2O=13700 cm-1 >Fe2+,△H2O=13700 cm-1。