基本介紹
- 中文名:共振雜化分子
- 外文名:resonance hybrid
- 書寫形式:共振式
- 用途:計算鮑林標度下的電負性
- 定義:共振結構或極限結構
來源,共振結構簡介,共振論,共振結構式,共振能,
來源
苯的共振式單一路易斯結構中,共價鍵的鍵級只能是整數,常與實驗數據或量子力學計算所得的結果不符。根據價鍵理論,可以寫出兩種不同的苯分子結構。但是實驗表明,苯分子中的C-C鍵長相等,處於單鍵和雙鍵之間,與單一的路易斯結構相矛盾。為了解釋這個現象,共振論認為苯實際上是這兩種結構的雜化體,兩種極限結構貢獻相等,因此苯的六個碳完全等同。
共振結構簡介
共振結構之間以雙向箭頭連線。根據情況不同,每一個共振結構對雜化體的貢獻程度不同。共振式中各共振結構的關係可以與正交坐標系中的矢量坐標類比。假設矢量r可以寫作xi+yj+zk(x,y,z是分矢量,i,j,k為坐標軸),那么r不是i、j或k中的任意一個,而是它們的特定組合,雜化體也是如此。三個並不存在的共振結構x、y和z,都對雜化體有貢獻,而且貢獻不同,它們的引入,可以在很大程度上方便理解分析雜化體的結構及性質。
共振論
基本思想
共振論是在經典結構式的基礎上對π電子離域的共軛分子結構式的書寫提出其基本思想的,即π-π和P-π共軛體系分子只用一個電子定域的經典結構式來描述時是無法描述(書寫)其真實結構,那就用幾個π電子分布不同的經典結構式的疊加或雜化來描述。即用不真實存在的經典結構式(叫共振式或極限式)表達分子的真實結構(共振雜化體)。故共振論更多強調的是結構式上的書寫,而且是構造式的書寫,不涉及立體結構。在理解共振論時,注意兩個概念:每一個經典價鍵結構式叫極限式或共振式,如下面例子中方括弧中的式子,每個極限結構式是不存在的,它只存在於人們的想像中;而所有極限式的疊加或雜化叫共振雜化體,如下面例子中左邊的非經典結構,即真實結構。也要注意π電子離域的共軛體系分子真實結構是客觀存在的,每一個極限式都不代表這個真實分子結構,能量均高於真實分子,以免出現理解錯誤。
共振論與價鍵理論
除了從路易斯結構圖上理解物質結構外,共振論還有利於從數學層面上理解價鍵理論(VB)。當某物質的性質無法用一個價鍵結構來描述時,即無法以激發、雜化和成鍵的過程解釋,那么共振論的概念便被引入,以便於理解結構。
再次以苯為例。價鍵理論中,先寫出苯分子兩種可能的路易斯結構,然後這兩種結構線性組合,形成的波函式中含有兩種結構各一半的貢獻。然而,大多數情況下極限結構的貢獻並不相等,這時可通過變分最最佳化先求得波函式的最低能量,作為最佳近似值得到貢獻的係數,再由此近似估計分子的真實結構。
共振論與分子軌道理論
在更複雜的分子軌道理論中,共振通常是π軌道中電子離域的同義詞。比如苯分子中,分子軌道示意圖表明6個π電子離域在6個碳原子上,碳-碳鍵鍵級超過單鍵,整個分子以正六邊形環外加中心的圓來表示更加妥當。一般教學中,常混合價鍵理論和分子軌道理論的思想,認為C-C之間不只存在σ鍵,而且還包括π電子的離域。
共振論與雜化軌道理論
雜化軌道理論在有機化學學習中起著十分重要的作用,對有機化合物σ和π鍵的形成都能很好的解釋,但是在書寫複雜共軛體系分子結構式時,經典結構式就遇到了困難;共振論因為是從經典結構理論引申出來的,因此與經典結構理論很相似,但是共振論的最大價值在於它能夠用較簡單的結構式表達複雜的離域分子。只是由於共振論是在經典結構的基礎上,不考慮電子的運動狀態和分子的立體結構的問題,加之書寫極限式個數隨意性很大,因此在套用上有一定的局限性。
共振結構式
書寫原則
因為共振論不能完全擺脫價鍵理論的固有局則———構造式的核不動,未成鍵電子數不變。當然書寫極限式的技巧可以簡單歸納為:先寫一個熟悉的極限式,然後將離域所涉及的電子一般為P電子沿碳鏈或沿碳環走一圈,單鍵與雙鍵互變,就可把可能的極限式書寫出來。
書寫中注意表達式之間:
1、各極限式用雙箭頭連線起來,所有的共振式用方括弧括起來;
2、用彎箭頭表示電子對的移動。
如:乙酸根的真實結構是2個極限式的共振雜化體: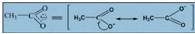

共振式與互變異構
共振式需要注意的是,每個極限結構實質上並不存在,雜化體具有單一特定的結構,也並不是極限結構的混合物或平衡體系。只是任何一個路易斯結構都無法準確地表達物質的結構,只有用極限結構雜化的思想來表達才更加確切。因此共振式與互變異構是截然不同的兩個概念,互變異構涉及原子位置的改變,而共振式則不然。
共振能
共振能雜化體的能量總是低於各極限結構,常用共振能的概念來表示該降低值。它被定義為雜化體能量低於最穩定極限結構能量的數值,常與另一個概念離域能混用。電子的離域降低了軌道能,增加了分子的穩定性,常會造成分子的芳香性,如苯。
共振能隨著極限結構數的增多而增大,尤其是存在等價極限結構時(能量相等)。可由量子化學計算、熱化學方法或分子的氫化熱來估計共振能。例如,氫化苯的一個雙鍵約需120kJ/mol的能量,乘以3得到苯的完全氫化需要的能量,大概為360kJ/mol。實驗測得苯的氫化熱只有210kJ/mol,因此,共振能便是剩下的150kJ/mol。
共振能可用於計算鮑林標度下的電負性。

