基本介紹
- 中文名:八音律
- 外文名:octaves
六元素表,“八音律”表,元素周期表,
六元素表
1862年,法國地質學家尚古多首先提出了元素隨著原子量的變化,其化學性質呈現周期性變化的問題。1864年德國化學家邁耶,按原子量遞增順序制定了一個“六元素表”。這個“六元素表”,1865年,英國化學家紐蘭茲按原子量遞增順序,將已知元素作了排列。他發現,到了第八個元素就與第一個元素性質相似,亦即元素的排列每逢八就出現周期性。
1864年邁耶(Meyer,1830-1895)發表了《六元素表》。在表中,他根據物理性質和相對原子質量遞增的順序把性質相似的元素六種、六種地進行分族,排出如下一張元素分類表:
Li Be C N O P
Na Mg Si P S Cl
K Ca As Se Br Rb
Sr Sn Sb Te I Cs
Ba Pb Bi Tl
“八音律”表
1865年,英國皇家農業學會化學師紐蘭茲(A.Y. Newlands,1837-1898)把當時已知的62種元素按相對原子質量由小到大的順序排列,發現從任意一種元素算起,每當排列到第八種元素時就會出現性質跟第一個元素相似的情況,猶如八度音階一樣,他把這個規律叫做"八音律"。
紐蘭茲從小受母親的影響,愛好音樂,覺得這好像音樂上的八個音階一樣重複出現,於是自己把它稱為“八音律”,畫出了“八音律”表。1866年3月當他在倫敦化學學會發表這一觀點時,得到的卻是嘲笑和諷刺;他的有關論文也被退稿。七年以後,他的論文又被拒絕發表。雖然紐蘭茲的“八音律”表存在著缺點和不成熟的地方,但他發現了元素的性質在排列上有周期性這一研討方向是完全正確的,而且在這個正確的方向上向前邁進了一大步。一直到18年以後,即在門捷列夫的元素周期表的重要性得到普遍承認以後,紐蘭茲的論文才得以發表,英國皇家學會才給他頒贈了勳章。
H1 Li2 G3 Bo4 C5 N6 O7
F8 Na9 Mg10 Al11 Si12 P13 S14
Cl15 K16 Ca17 Cr18 Ti18 Mn20 Fe21
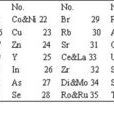
Co,Ni22 Cu23 Zn25 Y24 Zn26 As27 Se28
Br29 Rb30 Sr31 Ce,La33 Zr32 V,Mo34 Ro,Ru35
Pd36 Ag37 Cd38 U40 Sn39 Sb41 Fe43
I42 Cs44 Ba,V45 Ta46 W47 Nb48 Au49
Pt,Ir50 Tl53 Pb54 Th56 Hg52 Bi55 Os51