免疫診斷(immunodiagnosis)是套用免疫學的理論、技術和方法診斷各種疾病和測定免疫狀態。免疫診斷試劑在診斷試劑盒中品種最多,廣泛套用於醫院、血站、體檢中心,主要用於肝炎檢測、性病檢測、腫瘤檢測、孕檢等。其中,免疫診斷包括放射免疫、酶聯免疫、化學發光等。酶聯免疫試劑具有成本低、可大規模操作等特點;而化學發光試劑具有靈敏、快速、穩定、選擇性強、重現性好、易於操作、方法靈活多樣的優點。
基本介紹
- 中文名:免疫診斷方法
- 適用:醫學.法醫學
- 釋義:套用免疫學診斷疾病.免疫狀態
- 方法:體內和體外進行
醫法簡介,檢測方法,醫法套用,
醫法簡介
在醫學上,它是確定疾病的病因和病變部位,或是確定機體免疫狀態是否正常的重要方法。此外,還套用於法醫學的血跡鑑定、生物化學的血清成分鑑定和物種進化關係的研究等。可在體內和體外進行。
從免疫學的角度免疫診斷可套用於①檢查免疫器官和功能發生改變的疾病:如免疫缺陷病、自身免疫病;②由免疫機制引起的疾病:如輸血反應、移植排斥反應;③一些內分泌性的疾病:從臨床學的角度來說,免疫診斷可套用於檢查傳染性疾病、免疫性疾病、腫瘤和其他臨床各科疾病。就所檢測的反應物免疫診斷大致可以分為兩類,即①免疫血清學診斷:檢測病人血清或組織內有無特異性抗體或特異性抗原;②免疫細胞學診斷:測定病人細胞免疫力的有無和強弱。
免疫診斷須體現3項要求:①特異性強,儘量不出現交叉反應,不出現假陽性,以保證診斷的準確性;②靈敏度高,能測出微量反應物質和輕微的異常變化,有利於早期診斷和排除可疑病例;③簡便、快速、安全。
檢測方法
免疫學檢測方法是套用免疫學理論設計的一系列測定抗原、抗體、免疫細胞及其分泌的細胞因子的實驗方法。隨著學科間的相互滲透,免疫學涉及的範圍不斷擴大,新的免疫學檢測方法層出不窮。免疫學方法的套用範圍亦在日益擴大,不僅成為多種臨床疾病診斷的重要方法,也為眾多學科的研究提供了方便。本章將從抗原、抗體、免疫細胞和細胞因子檢測等方面概括介紹試驗的基本類型、原理和主要用途,並對分子生物學技術(分子雜交、轉基因、多聚酶鏈反應)在免疫學領域的套用作一簡要介紹。
第一節檢測抗原抗體的體外方法
抗原與相應抗體相遇可發生特異性結合,並在外界條件的影響下呈現某種反應現象,如凝集或沉澱,藉此可用已知抗原(或抗體)檢測未知抗體(或抗原)。試驗所採用的抗體常存在於血清中,因此又稱之為血清學反應(serological reaction)。
一、抗原抗體反應的特點
(一)抗原抗體結合的特異性
抗原藉助表面的抗原決定簇與抗體分子超變區在空間構型上的互補,發生特異性結合。同一抗原分子可具有多種不同的抗原決定簇,若兩種不同的抗原分子具有一個或多個相同的抗原決定簇,則與抗體反應時可出現交叉反應(cross reaction)。
(二)抗原抗體結合的可逆性
抗原抗體結合除以空間構型互補外,主要以氫鍵、靜電引力、范德華力和疏水鍵等分子表面的非共價方式結合,結合後形成的複合物在一定條件下可發生解離,回復抗原抗體的游離狀態。解離後的抗原和抗體仍保持原有的性質。抗原抗體複合物解離度在很大程度上取決於特異性抗體超變區與相應抗原決定簇三維空間構型的互補程度,互補程度越高,分子間距越小,作用力越大,兩者結合越牢固,不易解離;反之,則容易發生解離。
(三)抗原抗體結合的比例性與結合物的可見性
抗原與抗體的結合能否出現肉眼可見的反應,取決於兩者的比例。若比例合適,則可形成大的抗原抗體結合物,出現肉眼可見反應現象;反之,雖能形成結合物,但體積小,肉眼不可見。由於這種分子比例的差異,分別形成了三種區帶現象。等價帶表示抗原與抗體比例最合適,形成大而多的結合物,此時在反應體系中測不出或有極少游離的抗原或抗體;抗體過剩帶(前帶)和抗原過剩帶(後帶)皆表示抗原與抗體的比例不合適,所形成的結合物少且小,其反應體系中存在著游離的抗原或抗體。抗原抗體分子的比例與結合物大小的關係如圖18.1所示。小分子可溶性抗原,因其表面積大,容易導致後帶現象;而細胞等顆粒性抗原,在與抗體反應時則易出現前帶現象。因此在抗原抗體檢測中,為能得到肉眼可見的反應,在了解抗原的物理性狀之後,對抗原或抗體進行稀釋,以調整二者的比例。
圖18.1抗原-抗體反應模式圖
(四)抗原抗體反應的階段性
抗原抗體反應可分為兩個階段。第一階段是抗原抗體的特異結合階段,此階段僅需幾秒到幾分鐘、尚無可見反應;第二階段為可見反應階段,需數分鐘、數小時乃至數日,受各種因素影響。
二、抗原抗體反應的主要影響因素
(一)抗原和抗體濃度、比例
抗原和抗體濃度、比例對抗原抗體反應影響最大,是決定性因素,如前所述。
(二)電解質
抗原與抗體特異性結合後,其親水性減弱,分子表面所帶的電荷易受電解質影響而失去,複合物間的排斥力下降,導致第一階段已形成的可溶性結合物能進一步聯結,出現明顯的凝集或沉澱現象。試驗中常用0.85%的NaCl溶液作為稀釋液,以提供適當濃度的電解質。
(三)溫度
適當的溫度可增加抗原與抗體分子碰撞的機會,加速結合物體積的增大,一般而言溫度越高,形成可見反應的速度越快,但過高則會使抗原或抗體變性失活,影響試驗結果。一般在37℃下進行試驗,但也有些抗原抗體在4℃下進行反應較好。
(四)酸鹼度
pH過高或過低都將直接影響抗原或抗體的理化性質。例如,當pH降至3.0左右時,因接近細菌抗原的等電點,細菌表面蛋白或其他基團所帶的電荷消失,其相互間的排斥力喪失而導致非特異性酸凝集,影響試驗的可靠性。
三、抗原與抗體的製備
抗原與抗體是血清學反應的物質基礎。抗原的製備與純化是獲得特異性抗體的先決條件,所得到的抗體又可反過來純化和檢測抗原。
(一)抗原的製備
抗原種類繁多,按其物理性狀可分顆粒性和可溶性兩類。前者指細胞性抗原(包括細菌抗原),其製備較為簡便,一般用新鮮細胞以無菌生理鹽水或磷酸緩衝液洗滌後配成一定濃度。若系細菌抗原,則取新鮮培養物,經集菌作如下處理,H抗原因不耐熱用0.3%~0.5%甲醛處理,O抗原耐熱可加熱100℃2h去除H抗原後套用。可溶性抗原可以是細胞膜、細胞漿、細胞核及核膜等細胞組成部分,也可能是經細胞分泌至體液中的一些可溶性因子。細胞組成部分常需經過機械或酶解法等破碎、離心獲得粗製抗原,並通過選擇性沉澱或層析等方法進一步純化。而體液中(如血清等)的可溶性抗原則可直接用生化手段獲得所需成分。有些可溶性抗原僅具有免疫反應性,而無免疫原性,此類抗原尚需與載體偶聯方可成為完全抗原。
(二)抗體的製備
單克隆抗體和多克隆抗體:單克隆抗體(McAb)用雜交瘤技術製備(詳見第三章),其特點:特異性好,親和力高,只識別一個表位。多克隆抗體(polyclonal antibodies)存在於免疫動物的血清中,可通過直接分離血清獲得,主要套用於免疫學診斷。也可經中性鹽析和層析法進一步提出單一類別的免疫球蛋白(多為IgG),使診斷及各種研究在更精確的水平上進行。優點:可識別多個表位,缺點:特異性差,易出現交叉反應,親和力低,通過其他抗原的吸收可獲得針對單個抗原決定簇的單價因子血清。嵌合抗體和噬菌體抗體等基因工程抗體製備詳見第三章。
四、血清學反應的種類
抗原抗體反應種類甚多,為敘述方便按反應現象分類介紹於下。
(一)凝集反應(agglutination)
指顆粒性抗原(細菌、細胞等)與相應的抗體,或可溶性抗原(亦可用抗體)吸附於與免疫無關的載體形成致敏顆粒(免疫微球)與相應的抗體(或抗原),在有適量電解質存在下,形成肉眼可見的凝集小塊。
1.直接凝集反應(direct agglutination) 是顆粒性抗原又稱凝集原與相應抗體直接結合所呈現的凝集現象,如紅細胞和細菌凝集試驗。主要有玻片法、試管法及微量凝集法。玻片法為定性試驗,方法簡便快速,常用已知抗體檢測未知抗原,套用於菌種鑑定,分型及人紅細胞ABO血型測定等;試管法通常為半定量試驗,常用已知抗原檢測待檢血清中有無相應抗體及其相對含量,以幫助臨床診斷和分析病情。例如臨床實驗室常用的診斷傷寒或副傷寒的肥達氏試驗(Widal test);診斷布魯氏菌病的瑞特氏實驗(Wrig test)及診斷斑疹傷寒及恙蟲病的外裴二氏試驗(Weil felix test)等。
2.間接凝集反應(indirect passive agglutination) 是可溶性抗原或抗體吸附於與免疫無關的微球載體上,形成致敏載體(免疫微球),與相應的抗體或抗原在電解質存在的條件下進行反應,產生凝集,稱為間接凝集或被動凝集;實驗室常用的載體微球有人O型血紅細胞、綿羊或家兔紅細胞、聚苯乙烯乳膠、活性炭等,根據套用的載體種類不同,分別稱為間接血凝、間接乳膠凝集及間接炭凝試驗等。本試驗主要用於某些傳染病如鉤端螺旋體抗原和原發性肝癌的早期診斷。間接凝集反應擴大了凝集反應的套用範圍,其發展取決於載體,修飾載體使其帶有化學活性基團,或選用吸附力強、穩定性高和帶有色素的載體,必將演化出新的方法。
3.間接凝集抑制試驗(indirect agglutination inhibition test) 將可溶性抗原與相應抗體預先混合併充分作用後,再加入抗原致敏的載體,此時因抗體已被可溶性抗原結合,阻斷了抗體與致敏載體上的抗原結合,不再出現凝集現象,稱為間接凝集抑制試驗。臨床常用的免疫妊娠試驗(immune pregnancy test)即屬此類。若以紅細胞作為載體則稱為間接血凝抑制試驗。
所有上述凝集試驗均可劃分為正向和反向凝集試驗,以已知抗原測抗體的凝集試驗為正向凝集試驗,通常“正向”兩字省略,反之,為反向凝集試驗。
4.協同凝集試驗(co-agglutination) 以金黃色葡萄球菌為載體,利用其細胞壁中的A蛋白(SPA)具有結合人及多種哺乳動物IgG Fc段的特性。將特異性抗體結合至金黃色葡萄球菌菌體,其Fab段暴露於菌體表面,遇到相應抗原時與之結合,即可導致金黃色葡萄球菌凝集(圖18.2)。稱為協同凝集試驗。常用於早期診斷流腦、傷寒、菌痢及布魯氏菌病。
5.抗人球蛋白試驗(anti-human globulin reaction) 機體受抗原刺激後,除可產生完全抗體外,在某些病人(先天性溶血性貧血)也可產生不完全抗體(IgG),後者雖能與抗原結合,但不出現肉眼可見反應現象。Coomb等把含有不完全抗體血清球蛋白注射到異種動物體內,使其產生抗人球蛋白抗體,將該抗人球蛋白抗體加入到顆粒性抗原與相應的不完全抗體複合物中,就能出現肉眼可見的凝集現象,稱為抗人球蛋白試驗,又稱Coomb's試驗。主要用於檢測Rh抗體及布魯氏菌抗體。
(二)沉澱反應(precipitation)
可溶性抗原與相應抗體在有適量電解質存在下,出現肉眼可見的沉澱現象,稱為沉澱反應。參與反應的抗原稱沉澱原(precipitinogen),抗體稱沉澱素(precipitin)。沉澱原可以是多糖、蛋白質、類脂等,由於其體積小,相對反應面積大,故試驗時需對抗原進行稀釋,以避免後帶現象。套用較早的沉澱反應是環狀沉澱反應(ring precipitaion)和絮狀沉澱反應(flocculation precipitation),因其敏感性不高,已被淘汰。目前套用最多的沉澱反應是Oudin建立的凝膠(瓊脂)沉澱反應及其派生方法。
1.單向瓊脂擴散(simple agar diffusion) 簡稱單擴,將特異性抗體與熔化的瓊脂混合均勻,使抗體均勻分布於瓊脂,然後澆製成瓊脂板,再按一定要求打孔並加入抗原,使抗原向孔周自由擴散,與板中的抗體形成沉澱圈。本法為定量試驗,沉澱圈的直徑與抗原濃度成正比。單擴常用於血清中免疫球蛋白、AFP等的定量測定。
2.火箭電泳(rocket electrophoresis) 若在單向瓊脂擴散基礎上,加入抗原後,將瓊脂板置電場中,使抗原置於負極即向正極定向擴散,在與板中的抗體結合而形成錐形沉澱峰,形似火箭,故名火箭電泳。沉澱峰的高度與抗原濃度成正比。由於在電場作用下,促使帶負電荷多的抗原泳動,故火箭電泳需時短,可用於快速測定抗原含量,如在標本中加入少量同位素標記的抗原後,可作放射免疫自顯影,能檢出微量抗原。套用範圍與單擴相似。
3.雙向瓊脂擴散(double agar diffusion) 簡稱雙擴,先製備瓊脂板,再按要求打孔並分別加入抗原和抗體,使兩者同時在瓊脂板上擴散,若兩者對應且比例合適,則在抗原和抗體兩孔之間形成白色沉澱線。一對相應的抗原抗體只形成一條沉澱線,因此可根據沉澱線的數目推斷待測抗原液中有多少種抗原成分;根據沉澱線的吻合、相切或交叉形狀,可鑑定兩種抗原是完全相同、部分相同還是完全不同(圖18.4)。本法常用於定性測定抗原抗體,亦可用於判斷免疫血清的效價。
4.對流免疫電泳(counter immunoelectrophoresis) 若在雙擴基礎上加電泳,將抗原孔置負極端,抗體孔置正極端。由於抗原所帶的負電荷較抗體多,且抗原分子小於抗體,在電場中能夠克服電滲的作用而由負極泳向正極;抗體卻克服不了電滲作用,從正極向負極移動,二者形成對流,並在比例適宜處形成白色沉澱線,稱為對流電泳。因抗原抗體皆作定向運動,所以敏感性較雙擴為高。
除上述方法外還有多種免疫沉澱分析技術,如區帶電泳和雙擴相結合的免疫電泳(immunoelectrophoresis)、區帶電泳與火箭電泳聯用的交叉免疫電泳(cross immunelec-trophoresis),及免疫選擇電泳、免疫固定電泳等,分別套用於複雜抗原成分的分析和骨髓瘤、冷球蛋白血症等臨床疾病的輔助診斷。隨著精密儀器的研製成功,最近又建立了散射比濁、速率散射比濁等方法,使沉澱反應技術更加敏感、精確和自動化。
(三)補體結合試驗(complement fixation test,CFT)該試驗是在補體參與下,以綿羊紅細胞和溶血素作為指示系統,來檢測未知的抗原或抗體的血清學試驗。有五種成分參與,分為指示系統和待檢系統(已知抗原和未知抗體或已知抗體和未知抗原)。補體用新鮮豚鼠血清。方法是將已知的抗原或抗體與未知標本(可能含相應抗體或抗原)充分混合,再加入補體作用一段時間,最後加入指示系統。若待檢系統有相應抗體或抗原,則能形成抗原抗體複合物,從而消耗了補體不出現溶血現象,此為陽性;相反,出現溶血則為陰性。補體結合試驗的影響因素較多,正式試驗前需對已知成分作一系列滴定,尤其是補體,應選擇適宜的量參與反應,避免假性結果。每次試驗尚需同時設立多種對照,以作為判斷結果可靠性的依據。該法對顆粒性或可溶性抗原均適用,臨床上常用於檢測某些病毒、立克次氏體和螺旋體感染者血清內的中的抗體,亦可用於某些病毒的分型。
(四)中和反應(neutralization) 毒素、酶、激素或病毒等與其相應的抗體結合後,導致生物活性的喪失,稱為中和反應。常用的中和試驗有病毒中和試驗和毒素中和試驗。
1.病毒中和試驗(virus neutralization) 是檢測抗病毒抗體(中和抗體)的中和試驗。當機體感染病毒後,能產生特異性的抗病毒中和抗體,可使相應的病毒失去毒力。將待檢血清與病毒懸液混合,接種於細胞培養,根據對細胞的保護效果判斷病毒是否已被中和,並計算出“中和指數”,即代表中和抗體效價。該試驗可將已知免疫血清用於病毒鑑定,或用已知病毒檢測患者血清內的中和抗體,用於流行病學調查及病毒性疾病的診斷。
2.毒素中和試驗(toxinneutralization) 抗鏈球菌溶血素O試驗(antistreptolysin O test),簡稱抗“O”試驗,是體外的毒素抗毒素中和試驗。乙型溶血性鏈球菌能產生溶解人或兔紅細胞的溶血素O,具有抗原性,能刺激機體產生相應的抗體。當該毒素與相應抗體作用時,毒性被中和而失去溶血活性。試驗時,病人血清先與溶血素O混合,作用一定時間後加入人紅細胞,若不出現溶血表明待測血清中有相應抗體(抗O),即為陽性。本試驗可根據抗體的含量並結合臨床,幫助風濕病等免疫相關性疾病活動期的診斷。由於健康人血清中也有一定量的抗體,其含量與地區、季節、年齡等因素有關,因此檢測到抗體並不一定表明疾病處於活動期。而當效價高達500單位以上時,才有臨床意義。
(五)免疫標記技術
為提高抗原和抗體檢測的敏感性,將已知抗體或抗原標記上易顯示的物質,通過檢測標記物,反映有無抗原抗體反應,從而間接測出微量的抗原或抗體。常用的標記物有酶、螢光素、放射性同位素、膠體金及電子緻密物質等。這種抗原或抗體標記上顯示物所進行的特異性反應稱為免疫標記技術(immunolabelling technique)。
免疫標記不僅大大提高了試驗敏感性,若與光鏡或電鏡技術相結合,能對組織或細胞內的待測物質作精確定位,從而為基礎與臨床醫學研究及診斷提供方便。免疫標記技術大致分為兩大類:一類屬於免疫組織化學技術(immunohistochemical technique),用於組織切片或其他標本中抗原的定位。另一類稱為免疫測定(immunoassay),用於液體標本中抗原或抗體的測定。
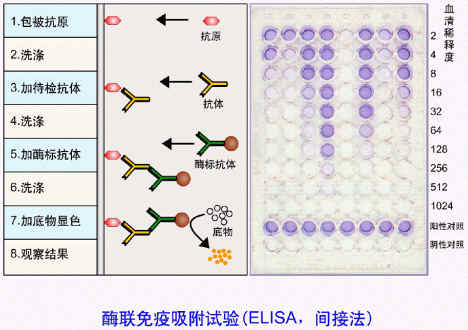
免疫酶技術(immunoenzymatic technique) 最早套用的免疫酶技術是免疫酶組織化學染色,即用標記的抗體與標本中的抗原發生特異性結合,當加入酶的底物時,在酶的作用下經一系列生化反應產生有色物質,藉助光鏡作出定位判斷。目前,套用最廣泛的是酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)。該法特異性強,敏感性高,既可檢測抗體,又能測定可溶性抗原。主要方法及操作要領見圖18.5,除了圖示的兩種方法外,還有抗原競爭法,現較少套用。ELISA常採用的酶為辣根過氧化物酶(hosradish peroxidase,HRP),其底物是二氨基苯胺(DAB),底物被分解則呈棕褐色,可目測或藉助酶標儀比色。ELISA為非均相免疫測定,另外還有均相法,在此不作介紹。
由於酶免疫測定無需特殊儀器和試劑,且操作簡便,利於普及。因此,在免疫標記技術中,該法套用最為廣泛,並在原有方法基礎上加以改良,使得眾多新的,更敏感的方法應運而生。①生物素-親和素放大系統(biotin-avidin system,BAS),建立於70年代後期,通過將酶標記在生物素或親和素上,藉助生物素與親和素的高度親力和生物素能與抗體結合的特點套用於ELISA,顯著提高了檢測的敏感性。②雙表位ELISA(two-site ELISA),其方法同雙抗體夾心法,只是將包被的抗體和酶標抗體換成針對兩個不同抗原決定簇的單抗,用於檢測單抗的親和性及表位特異性,亦可用於標本中抗原的快速檢測,即在試驗時可將待測抗原與酶標單抗同時加入反應體系,減少檢測步驟。③斑點免疫滲濾試驗(dot immunofiltration assay,DIFA),其原理與ELISA相同,但以微孔膜(如硝酸纖維素膜、尼龍膜等)代替聚苯乙烯板作載體。試驗時,將包被有抗原或抗體的微孔濾膜貼置於吸水材料上,依次滴加的標本、酶結合物、底物,分別進行洗滌,多餘的標本和酶標抗體及洗滌液等可滲濾入吸水材料中,最後陽性標本在膜上呈現著色斑點。④酶聯免疫電轉移印漬法(enzyme linked immunoelectrotransferblot,ELIB),該法將免疫轉印技術與酶標技術相結合,有利於分析和檢測更加複雜的抗原成分。ELIB分三階段進行。第一階段為SDS-聚丙烯醯胺凝膠電泳,先將抗原分成不同的區帶(肉眼不可見);第二階段為轉移電泳,即將凝膠上的電泳區帶經電泳轉移至硝酸纖維素膜上;第三階段為酶免疫定位,用特異性抗體和酶標抗抗體作間接ELISA,結果陽性區帶呈顯色反應。
2.免疫螢光技術(immunofluorescence techniques) 該法是以螢光素,如異硫氰酸螢光素(fluorescence isothiocyanate,FITC)、羅丹明等標記抗體或抗原,以檢測標本中抗原或抗體的方法。免疫螢光技術也包括兩種基本類型,即螢光抗體染色(fluorescentantiboby technique)和螢光免疫測定(fluorescein immunoassay)。①螢光抗體染色:是用螢光抗體浸染可能含有抗原的細胞或組織切片,若有相應抗原存在,則抗原與螢光抗體結合而使螢光素不被洗脫,在螢光顯微鏡下可見發光的物體,從而達到定位檢測目的,在基礎與臨床醫學的研究及疾病的診斷等方面有著廣泛用途。根據螢光抗體的不同可分直接法和間接法,前者即用螢光標記的第一抗體直接檢測標本片上的抗原,如病毒及某些蛋白質成分等;後者則在未標記的相應抗體(第一抗體)處理標本片後,覆以螢光標記的抗球蛋白抗體(第二抗體),藉此可檢測多種抗原與抗體。與直接法相比,間接法僅需標記一種第二抗體即可適應多種抗原抗體系統的檢測,且敏感性較高。②螢光免疫測定:本法與酶免疫測定一樣,可分均相和非均相法。均相法常利用螢光的某些特性,如螢光的激發、吸收、猝滅等設計試驗,無需作結合的與游離的標記物分離。雙標記法即為均相螢光免疫測定的一種類型,檢測試劑為FITC標記的抗原和羅丹明標記的抗體,當兩種標記物標記的抗原和抗體特異性結合後使兩種螢光素靠近,由於FITC的發射光譜能被羅丹明吸收,從而使FITC的螢光明顯減弱。試驗時將可能含有抗原的標本與兩種標記物一起反應,則能與FITC標記的抗原競爭結合羅丹明標記的抗體,從而減少羅丹明對FITC發射光譜的吸收。通過FITC螢光測定可推算出標本中抗原的量,其與螢光強度成正比。非均相法限於實驗室條件、試劑和容器或載體的非特異性螢光干擾等,套用不及ELISA廣泛。近年建立的時間分辨螢光免疫測定(time resoloved fluorescence immunoassay,TR-FIA)有很大改進,該法利用稀土金屬(銪、鋱等)的螯合物具有特長的螢光壽命,將其標記抗體並延長測定時間,以使短命的非特異性螢光衰退,從而測得均一的長壽命稀土螯合物螢光。此外稀土螯合物的激發光吸收峰(340nm)與螢光發射峰(613nm)之間的差別顯著,也利於排除非特異螢光的干擾。目前已用於IgE等微量血清成分及激素和某些藥物水平的測定。
3.放射免疫測定(radioimmunoassay,RIA) RIA是最敏感的免疫標記技術,精確度高且易規格化和自動化。但由於放射性同位素有一定的危害性,使其臨床套用受到一定限制。目前主要套用於激素(如HCG、胰島素)和藥物濃度的檢測。①液相放射免疫分析:為經典的放射性同位素標記技術(radio-isotypelabeliingtechnique),簡稱放射免疫分析。其原理是用已知的標記抗原與標本中可能存在的抗原競爭一定量的已知抗體,分別形成標記的和無標記的抗原抗體結合物。再經某些途徑分離結合的(B)與游離的(F)標記物,並根據測得的放射性強度,算出結合率[B/B+F],此與標本中抗原的量成反比。試驗時除作標本檢測外,還要以不同濃度的已知抗原參與反應得到的數據繪製出競爭抑制曲線,作為定量分析的依據。液相放射免疫測定的另一類型是免疫放射測定(immunoradionmetricassay,IRMA),試驗時受檢抗原與過量的標記抗體反應,然後加入固相的抗原免疫吸附劑,以結合游離的標記抗體,經離心後測定上清液中放射性強度,從而推算出標本中抗原的含量。②固相放射免疫測定(solidphase radioimmunoassay,SPRIA):其原理、方法和套用與ELISA基本相同,區別在於標記物和檢測儀。SPRIA的敏感性略高於ELISA。與RIA相比,該法既可用已知的標記抗原測抗體,也可用已知的標記抗體測抗原。主要套用於特異性IgE的檢測。
4.免疫膠體金標記技術(immunologic colloidal gold signature,ICS) 膠體金是分散相粒子的金溶液,經凝聚法製成的金溶膠顆粒表面帶有較多電荷,能吸附抗體形成金標記的抗體。用這種金標記抗體與組織或細胞標本中的抗原反應,藉助顯微鏡觀察顏色分布即可定位、定性測定組織或細胞中的抗原。該法最早用於免疫膠體金標記電鏡技術,利用膠體金顆粒高電子密度,經襯染後對超微切片中的抗原作定量或定位研究。繼後又套用於光鏡並根據金催化還原銀離子的原理,結合攝影技術以銀增強金標抗體的可見性,建立了免疫金銀法(IGSS)。此外,若將螢光素吸附於膠體金,在螢光顯微鏡下作定向性分布及定位觀察螢光染色標本,可增強螢光效果。膠體金標記技術發展較快,如膠體金斑點滲濾試驗和膠體金斑點免疫層析試驗,尤其是後者檢測敏感度高,操作簡單,時間短,1~2分鐘即可出現結果,已套用於HCG和HBV和兩對半的檢測。方法簡述如下(圖18.6),試驗用的均為乾試劑,多個試劑被組合在一狹長的試劑條上,條上端(A)和下端(B)分別為吸水性材料,膠體金標記的特異性抗體乾片貼上在B的近D處,緊接著為硝酸纖維膜,其上有兩個反應區域,測試區(T)包被有與待檢抗原相應的特異性抗體,對照區(C)包被有對應的抗IgG抗體(二抗)。測試時將試紙下端浸入液體標本中,通過吸水材料虹吸作用吸引標本液向上移動,經過D處時如標本中有與金標抗體相應的抗原,兩者即結合,膠體金顆粒發生聚集變為紅色。反之則不發生變化。過剩膠體金標記的抗體繼續向前,與對照區的二抗結合,出現紅色質控條帶。
醫法套用
已有許多新生物學技術套用於免疫學研究,促進了免疫學的發展,豐富了免疫學檢測的內容,使免疫學研究與相關疾病的診斷建立在基因水平,提高了檢測的敏感性和可靠性。
一、分子雜交技術 分子雜交的基本原理是根據雙鏈DNA經高溫解鏈成兩條互補的單鏈,降溫後又可恢復原來的雙鏈。兩條不同的單鏈分子可根據鹼基配對的原則,只要它們的鹼基序列同源或部分同源,即可全部或部分復性,此稱核酸雜交。用來探測DNA的已知互補片段稱為DNA探針,通常是套用已預先經放射性標記或非放射性標記的DNA單鏈來識別另一核酸分子中與其同源的部分,其特異性和敏感性極高。實驗方法有印跡雜交(southern blot)、斑點雜交和原位雜交。目前分子雜交技術已套用於免疫球蛋白分子、T細胞受體、補體、細胞因子以及MHC分子的基因結構、功能及表達等方面的研究。
二、轉基因技術
轉基因技術是近年來生物技術中的一項重大突破。其建立使得動物可不必通過有性雜交即能獲得新的基因。其基本原理是通過顯微注射或逆轉錄病毒,將外源性基因導入哺乳動物的受精卵或其早期胚胎,並經分子雜交分析胚胎或其後代組織中是否有外源性基因存在及其在體內的表達情況。目前通過轉基因技術建立的轉基因鼠,已套用於研究多種免疫分子的基因表達、自身反應性T細胞的負選擇作用及自身耐受機制、MHC的表達與糖尿病的關係等。此外也可將分離的目的基因與載體(質粒或噬菌體)通過粘性末端結合後,轉移至原核或真核細胞,使其整合到宿主細胞DNA上,藉以生產重組細胞因子等,為進一步研究免疫分子的結構與功能及臨床疾病的診斷提供理想的製劑。
三、多聚酶鏈反應
多聚酶鏈反應(polymerase chain reaction,PCR)又稱體外核酸擴增技術,即對特定DNA片段進行非細胞依賴性擴增,其基本過程是將已提取的待測DNA在一對寡核苷酸引物、三磷酸核苷及耐熱DNA多聚酶存在的情況下,分別於90℃、55℃和72℃下經變性、退火和核苷酸鏈的延伸,如此循環數十次以擴增DNA。擴增物經溴乙錠染色後作凝膠電泳,再於紫外燈下觀察特定鹼基對數的DNA片段,以出現橙紅色的電泳帶為陽性。若需進一步鑑定,可將凝膠分離的DNA回收再用特異性探針進行雜交分析。
PCR在免疫學中通常套用於癌基因、凋亡相關基因的表達、HLA的定型與基因分析、免疫球蛋白和T細胞受體多樣性研究以及細胞因子、粘附分子的檢測。PCR的方法有30餘種,如多重PCR、巢式PCR、二次PCR、共享引物PCR、逆轉錄PCR、錨定PCR等等。現臨床研究最常用的是逆轉錄PCR,現簡介如下:首先提取細胞總RNA,然後在逆轉錄酶的作用下,以mRNA為模板合成cDNA,隨後加入特異性引物進行擴增,再經瓊脂糖電泳檢測特異性的DNA,從而反映出某種基因的轉錄狀況。