光化學反應又稱光化作用,是指物質由於光的作用而引起的化學反應。即物質在可見光或紫外線的照射下吸收光能而發生的化學反應。例如碳水化合物的合成,染料在空氣中的褪色,膠片的感光作用等。範圍很廣,可能是化合、分解、氧化、還原等化學反應。主要有光合作用和光解作用兩種。
基本介紹
- 中文名:光化學反應
- 外文名:Actinic action
- 基本定律:光化學第一、二定律等
- 種類:光合作用;分解作用
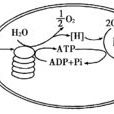
光化學反應又稱光化作用,是指物質由於光的作用而引起的化學反應。即物質在可見光或紫外線的照射下吸收光能而發生的化學反應。例如碳水化合物的合成,染料在空氣中的褪色,膠片的感光作用等。範圍很廣,可能是化合、分解、氧化、還原等化學反應。主要有光合作用和光解作用兩種。
光化學反應又稱光化作用,是指物質由於光的作用而引起的化學反應。即物質在可見光或紫外線的照射下吸收光能而發生的化學反應。例如碳水化合物的合成,染料在空氣中的...
光化學的定義有不同的表述。C. H. Wells認為,光化學研究的是“吸收了紫外光或可見光的分子所經歷的化學行為和物理過程”。N. J. Turro則認為“光化學研究的...
光化學煙霧(photo-chemical smog)是汽車、工廠等污染源排入大氣的碳氫化合物(HC)和氮氧化物(NOx)等一次污染物在陽光(紫外光)作用下發生光化學反應生成二次污染物...
光化學反應儀,又稱為光化學反應釜,多功能光化學反應器,光催化反應裝置,主要用於研究氣相、液相固相、流動體系在模擬紫外光、模擬可見光、特種模擬光照射下,是否負載...
光敏反應是指由光敏劑引發的光化學反應。光敏反應在醫學上一般指的是藥物的光敏反應,即使用藥物後,暴露於紫外線所產生的不良反應。...
普通有機化學反應(加熱供給活化能)所不能進行的特殊類型變化,有時可借光化學方法來實現。光活化的反應物分子常為雙自由基。...
光化學重排反應是指基態分子吸收光能後,發生分子內原子丟失或結構片段位置的重排生成另一個化合物的過程,在結構複雜分子的合成以及有機生物學領域均具有特殊的作用。...
《光化學基礎與套用》是2010年化學工業出版社出版的圖書,作者是李曄。...... 光化學反應、雷射簡介、分子光譜的時間分辨和空間分辨、自然界中神奇的分子卟啉、光合作...
自由基反應又稱游離基反應,是自由基參與的各種化學反應。自由基電子殼層的外層有一個不成對的電子,對增加第二個電子有很強的親和力,故能起強氧化劑的作用。大氣...
光化反應是指由光照射引起的化學反應稱為光化學反應。...... 光化反應是指由光照射引起的化學反應稱為光化學反應。中文名 光化反應 外文名 光化反應 引起 ...
光化學方法是一種利用光能量激活反應物質而發生化學反應的方法。簡稱光化法。反應物吸收光子後,成鍵或非鍵軌道上的電子被激發到反鍵軌道上,導致鍵的削弱甚至斷裂,...
《光化學技術》是2004年10月1日化學工業出版社出版的圖書,作者是曹怡。本書主要介紹了光化學在合成技術、太陽能利用、光功能材料、光生物化學和環境光化學等領域的...
平流層光化學的研究內容是地球大氣平流層中發生的光化學反應。平流層最主要的特徵之一是臭氧含量較高,所以平流層光化學的主要研究對象是臭氧的光化學反應,包括...
光化學儲能是指利用光化學反應進行儲能的技術。光化學反應又稱光化作用,是指物質一般在可見光或紫外線的照射下而產生的化學反應,是由物質的分子吸收光子後所引發的...
《現代光化學》是2006年化學工業出版社出版圖書,作者是張建成、王奪元。本書介紹了現代光化學基礎知識、基本原理和基本有機光化學反應,以及光功能材料、生物光化學...
美國洛杉磯光化學煙霧事件是 1940 年至 1960 年間發生在美國洛杉磯的有毒煙霧污染大氣的事件,世界有名的公害事件之一。在 1952 年 12 月的一次光化學煙霧事件中...
《化學反應動力學》是2005年1月化學工業出版社出版的圖書,作者是許越。...... 第九章光化學反應動力學第一節光化學概述一.光化學反應的基本特點二.光化學反應的...
