基本介紹
- 藥品名稱:任捷
- 藥品類型:處方藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,生產企業,核准日期,
成份
主要成份:重組人凝血因子Ⅷ。
輔料:聚山梨酯80、 蔗糖、L-組氨酸、 二水合氯化鈣、氯化鈉等。
輔料:聚山梨酯80、 蔗糖、L-組氨酸、 二水合氯化鈣、氯化鈉等。
性狀
白色餅狀物,按標示量加入稀釋液復溶後應為澄明液體,無可見不溶性微粒。
適應症
[u]甲型血友病患者出血的控制和預防[/u]
本品適用於甲型血友病(先天性凝血因子Ⅷ缺乏)患者出血的控制和預防。
本品不含血管假性血友病因子,因此不適用於治療血管性血友病(von Willebrand disease,vWD)。
[u]甲型血友病患者的手術預防[/u]
本品適用於甲型血友病患者的手術出血預防。
本品適用於甲型血友病(先天性凝血因子Ⅷ缺乏)患者出血的控制和預防。
本品不含血管假性血友病因子,因此不適用於治療血管性血友病(von Willebrand disease,vWD)。
[u]甲型血友病患者的手術預防[/u]
本品適用於甲型血友病患者的手術出血預防。
規格
250 IU/瓶、500 IU/瓶、1000 IU/瓶、2000 IU/瓶。
用法用量
用藥劑量
本品應在有甲型血友病治療經驗的醫師指導下使用。
本品的劑量和治療持續時間取決於患者因子Ⅷ缺乏的嚴重程度、出血的部位與範圍以及患者的臨床狀況。應根據患者的臨床反應調整給藥劑量。在大手術或危及生命的出血事件中,對此替代治療進行監控尤為重要。
本品所標示的一個國際單位 (IU)的因子Ⅷ的活性大約相當於1 ml正常人血漿中的因子Ⅷ的含量。所需因子Ⅷ劑量的計算基於實踐經驗,即每公斤體重的1 IU 因子Ⅷ平均可使血漿因子Ⅷ的活性升高約2 IU/dL。可用下面的公式計算所需劑量:
需要劑量(IU)= 體重(kg) × 因子Ⅷ期望升高值(IU/dL或% )× 0.5 [(IU/kg)/(IU/dL)]
對下列出血的控制和手術預防,根據以下的分期,因子Ⅷ活性不應低於下述相應階段的特定血漿因子活性水平(以正常值的%或IU/dL表示)。
表1.控制出血和手術預防的給藥劑量
出血類型 所需因子Ⅷ水平(%)給藥頻率(小時)/治療持續時間(天)
少量出血
早期關節積血\淺表肌肉 20~40 根據需要,每12~24小時重複給藥,直至緩解.
或軟組織和口腔出血 根據出血的嚴重程度,至少治療1天.
中度出血和小手術
中度肌肉內出血;輕度頭部 每12~24小時重複輸注,治療3~4天,或知道止
外傷.小手術,包括拔牙. 30~60血和傷口癒合.在拔牙時,1小時內接受單次
口腔出血. 輸注加口服抗纖溶藥物可能足夠.
大出血和大手術
胃腸道出血;顱內\腹腔或 60~100每8~24小時重複輸注,直至危險消除,或止血
胸腔內出血;骨折.大手術. 和手術傷口癒合.
推薦套用測定血漿中因子Ⅷ活性的方法監測本品的替代治療,尤其對於外科手術的干預。臨床數據支持使用一期法監測本品的治療。
根據每個甲型血友病患者當前的治療方案,應建議在旅行時攜帶充足的因子Ⅷ產品,以滿足預期的治療需要。應建議患者在旅行之前諮詢醫師。
使用說明
使用本品包裝中所提供的預裝注射器中的稀釋劑(0.9 %氯化鈉溶液)復溶凍乾粉後,進行靜脈注射給藥。
配製:
·在進行下列操作前須洗淨雙手。
·在復溶操作中應採用無菌操作(即潔淨和無菌)。
·本品復溶和給藥所用的所有物品應在開啟其無菌包裝後儘快使用,以減少在空氣中不必要的暴露。
注意:如輸注時需要使用1瓶以上的本品,每瓶藥物都應按下列使用說明進行復溶。應移除稀釋液注射器,將接合器留在藥瓶上,可另用1支一次性大容量無菌注射器,如路厄旋扣注射器(luer lock syringe)抽取每瓶內的復溶物。直到抽取下一瓶藥物時,才應當把待抽取藥物的稀釋液注射器移除,並將大容量路厄旋扣注射器從上一瓶藥物中取出插入待抽取藥物瓶中。
復溶:
1. 使本品瓶內凍乾粉末和預裝稀釋液的注射器放置至室溫。
2. 移除小瓶上的塑膠蓋,露出膠塞的中央部分。
3. 用酒精棉或使用其它消毒溶液擦拭藥瓶頂部,自然晾乾。消毒後,切勿用手觸摸膠塞,也防止膠塞觸及任何物體。
4. 揭開接合器的透明塑膠包裝保護套。但不要將接合器從包裝內取出。
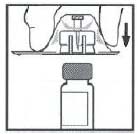
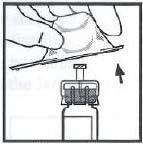
5. 將藥瓶放置在一個平整的檯面上。握住包裝中的接合器,放在藥瓶上方。用力下壓包裝,直到接合器的針頭刺入瓶塞內。
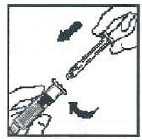
6. 如圖所示,拿穩稀釋液注射推桿底部,並通過嚴實推壓及旋轉將注射器推桿的螺紋端裝入稀釋液注射器柱塞中。操作過程中避免觸及注射器的推桿體部。
7. 折斷注射器護套的穿孔處,從注射器上折下防啟塑膠尖嘴護套。不要觸摸護套的內側或注射器尖部。由於稀釋液注射器可能需要用護套重新蓋住(如果已復溶的本品不立即使用),因此需將護套倒置放在一個乾淨、最不易被環境污染的檯面上。
8. 提起接合器的塑膠包裝並丟棄包裝。
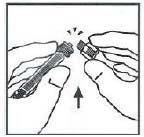
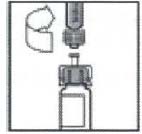
9. 將藥瓶放在平整的檯面上。將注射器尖部插入接合器開口處,順時針用力旋轉推動注射器直到鎖定,以將稀釋液注射器連線在接合器上。
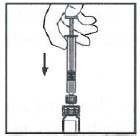
10. 緩慢下壓注射器推桿,將所有稀釋液注入藥瓶內。
11. 保持注射器與接合器相連線,輕輕搖晃藥瓶內的液體,直到粉末溶解。
注意:注射前應肉眼檢查最終溶液有無顆粒物質;此溶液應為無色澄清至淡乳白色,否則應丟棄另使用新的本品。
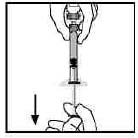
12. 倒置藥瓶,緩慢將溶液吸入注射器內。
13. 緩緩地逆時針旋轉拔出注射器,將注射器與接合器分離。丟棄藥瓶與接合器。
注意:如果不立即使用,應小心蓋上注射器護套。不要觸摸注射器尖部或注射器護套的內側。
給藥前,復溶後的溶液可在室溫下保存。但必須在復溶後3小時內給藥。
本品復溶後含有聚山梨酯80,已知其可增加鄰苯二甲酸二-(2-乙基己基)鹽(DEHP)從聚氯乙烯(PVC)中的提取。這一點在本品的配製和給藥(包括在PVC容器中的保存時間)過程中應予以注意。應嚴格按照【用法用量】中的建議使用本品。
給藥:
使用本品包裝中提供的預裝注射器內稀釋液(0.9 %氯化鈉溶液,4 ml)復溶本品後,靜脈注射給藥。給藥前應檢查本品中有無顆粒物及是否變色。
注射本品時,應使用本品包裝中所提供的靜脈輸液針和預裝稀釋液注射器,或一次性無菌注射器(如大容量的路厄旋扣注射器)。此外,應使用所附接合器從藥瓶中抽吸溶液。
1. 將注射器連線到附帶的靜脈輸液針的螺旋口端。
2. 紮好止血帶,用酒精棉擦拭注射部位。
3. 進行靜脈穿刺。將靜脈輸液針的針頭刺入靜脈內,取下止血帶。應在幾分鐘內完成本品靜脈注射。根據患者的舒適程度決定注射速度。
復溶後的本品不能與其它藥品共用同一導管或容器。
注射完畢後,取下並丟棄靜脈輸液針。將所有未使用的溶液、空瓶及使用過的針頭和注射器棄入合適的容器內,以防處理不當傷及他人。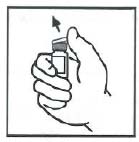
本品應在有甲型血友病治療經驗的醫師指導下使用。
本品的劑量和治療持續時間取決於患者因子Ⅷ缺乏的嚴重程度、出血的部位與範圍以及患者的臨床狀況。應根據患者的臨床反應調整給藥劑量。在大手術或危及生命的出血事件中,對此替代治療進行監控尤為重要。
本品所標示的一個國際單位 (IU)的因子Ⅷ的活性大約相當於1 ml正常人血漿中的因子Ⅷ的含量。所需因子Ⅷ劑量的計算基於實踐經驗,即每公斤體重的1 IU 因子Ⅷ平均可使血漿因子Ⅷ的活性升高約2 IU/dL。可用下面的公式計算所需劑量:
需要劑量(IU)= 體重(kg) × 因子Ⅷ期望升高值(IU/dL或% )× 0.5 [(IU/kg)/(IU/dL)]
對下列出血的控制和手術預防,根據以下的分期,因子Ⅷ活性不應低於下述相應階段的特定血漿因子活性水平(以正常值的%或IU/dL表示)。
表1.控制出血和手術預防的給藥劑量
出血類型 所需因子Ⅷ水平(%)給藥頻率(小時)/治療持續時間(天)
少量出血
早期關節積血\淺表肌肉 20~40 根據需要,每12~24小時重複給藥,直至緩解.
或軟組織和口腔出血 根據出血的嚴重程度,至少治療1天.
中度出血和小手術
中度肌肉內出血;輕度頭部 每12~24小時重複輸注,治療3~4天,或知道止
外傷.小手術,包括拔牙. 30~60血和傷口癒合.在拔牙時,1小時內接受單次
口腔出血. 輸注加口服抗纖溶藥物可能足夠.
大出血和大手術
胃腸道出血;顱內\腹腔或 60~100每8~24小時重複輸注,直至危險消除,或止血
胸腔內出血;骨折.大手術. 和手術傷口癒合.
推薦套用測定血漿中因子Ⅷ活性的方法監測本品的替代治療,尤其對於外科手術的干預。臨床數據支持使用一期法監測本品的治療。
根據每個甲型血友病患者當前的治療方案,應建議在旅行時攜帶充足的因子Ⅷ產品,以滿足預期的治療需要。應建議患者在旅行之前諮詢醫師。
使用說明
使用本品包裝中所提供的預裝注射器中的稀釋劑(0.9 %氯化鈉溶液)復溶凍乾粉後,進行靜脈注射給藥。
配製:
·在進行下列操作前須洗淨雙手。
·在復溶操作中應採用無菌操作(即潔淨和無菌)。
·本品復溶和給藥所用的所有物品應在開啟其無菌包裝後儘快使用,以減少在空氣中不必要的暴露。
注意:如輸注時需要使用1瓶以上的本品,每瓶藥物都應按下列使用說明進行復溶。應移除稀釋液注射器,將接合器留在藥瓶上,可另用1支一次性大容量無菌注射器,如路厄旋扣注射器(luer lock syringe)抽取每瓶內的復溶物。直到抽取下一瓶藥物時,才應當把待抽取藥物的稀釋液注射器移除,並將大容量路厄旋扣注射器從上一瓶藥物中取出插入待抽取藥物瓶中。
復溶:
1. 使本品瓶內凍乾粉末和預裝稀釋液的注射器放置至室溫。
2. 移除小瓶上的塑膠蓋,露出膠塞的中央部分。
3. 用酒精棉或使用其它消毒溶液擦拭藥瓶頂部,自然晾乾。消毒後,切勿用手觸摸膠塞,也防止膠塞觸及任何物體。
4. 揭開接合器的透明塑膠包裝保護套。但不要將接合器從包裝內取出。
5. 將藥瓶放置在一個平整的檯面上。握住包裝中的接合器,放在藥瓶上方。用力下壓包裝,直到接合器的針頭刺入瓶塞內。
6. 如圖所示,拿穩稀釋液注射推桿底部,並通過嚴實推壓及旋轉將注射器推桿的螺紋端裝入稀釋液注射器柱塞中。操作過程中避免觸及注射器的推桿體部。
7. 折斷注射器護套的穿孔處,從注射器上折下防啟塑膠尖嘴護套。不要觸摸護套的內側或注射器尖部。由於稀釋液注射器可能需要用護套重新蓋住(如果已復溶的本品不立即使用),因此需將護套倒置放在一個乾淨、最不易被環境污染的檯面上。
8. 提起接合器的塑膠包裝並丟棄包裝。
9. 將藥瓶放在平整的檯面上。將注射器尖部插入接合器開口處,順時針用力旋轉推動注射器直到鎖定,以將稀釋液注射器連線在接合器上。
10. 緩慢下壓注射器推桿,將所有稀釋液注入藥瓶內。
11. 保持注射器與接合器相連線,輕輕搖晃藥瓶內的液體,直到粉末溶解。
注意:注射前應肉眼檢查最終溶液有無顆粒物質;此溶液應為無色澄清至淡乳白色,否則應丟棄另使用新的本品。
12. 倒置藥瓶,緩慢將溶液吸入注射器內。
13. 緩緩地逆時針旋轉拔出注射器,將注射器與接合器分離。丟棄藥瓶與接合器。
注意:如果不立即使用,應小心蓋上注射器護套。不要觸摸注射器尖部或注射器護套的內側。
給藥前,復溶後的溶液可在室溫下保存。但必須在復溶後3小時內給藥。
本品復溶後含有聚山梨酯80,已知其可增加鄰苯二甲酸二-(2-乙基己基)鹽(DEHP)從聚氯乙烯(PVC)中的提取。這一點在本品的配製和給藥(包括在PVC容器中的保存時間)過程中應予以注意。應嚴格按照【用法用量】中的建議使用本品。
給藥:
使用本品包裝中提供的預裝注射器內稀釋液(0.9 %氯化鈉溶液,4 ml)復溶本品後,靜脈注射給藥。給藥前應檢查本品中有無顆粒物及是否變色。
注射本品時,應使用本品包裝中所提供的靜脈輸液針和預裝稀釋液注射器,或一次性無菌注射器(如大容量的路厄旋扣注射器)。此外,應使用所附接合器從藥瓶中抽吸溶液。
1. 將注射器連線到附帶的靜脈輸液針的螺旋口端。
2. 紮好止血帶,用酒精棉擦拭注射部位。
3. 進行靜脈穿刺。將靜脈輸液針的針頭刺入靜脈內,取下止血帶。應在幾分鐘內完成本品靜脈注射。根據患者的舒適程度決定注射速度。
復溶後的本品不能與其它藥品共用同一導管或容器。
注射完畢後,取下並丟棄靜脈輸液針。將所有未使用的溶液、空瓶及使用過的針頭和注射器棄入合適的容器內,以防處理不當傷及他人。










不良反應
臨床試驗
以下匯總了本品國外臨床研究300、301、306、307、310和311所有的不良反應。表2中不良反應發生率基於每次輸注藥物後的統計。
使用本品可能發生變態反應型超敏反應。超敏反應的表現可能包括蕁麻疹、全身性蕁麻疹、胸部壓迫感、哮鳴、低血壓和過敏性反應。
如果發生任何反應,認為與本品的給藥相關,應根據患者的反應降低靜脈注射速度或終止注射本品。
免疫原性(中和抗體)
甲型血友病患者可能產生中和因子Ⅷ的抗體(抑制物)。與所有凝血因子Ⅷ產品一樣,應當對患者的抑制物形成進行監測,套用Nijmegen改進的Bethesda分析,以Bethesda單位(BU)定量。此類抑制物的出現,可能表現為臨床反應不佳或出現非預期的血漿因子Ⅷ活性水平低下。此情況下建議與血友病專科聯繫。
臨床試驗期間和上市後收到的療效不足報告主要來源於預防使用的患者。產生了抑制物的患者曾報告過療效不足和/或因子Ⅷ恢復情況不佳的事件,但未發現抑制物的患者也出現過這些情況。療效不足表現為:特定關節出血、新發現的關節出血、其他出血或患者發現的新部位自發性出血。為了確保充分的治療反應,必須對每例患者進行個體化的遞增劑量並進行監測,尤其是在開始接受本品治療的初期。
在關鍵的III期臨床研究中(研究310),既往接受過治療的甲型血友病患者用本品進行常規預防和按需治療,94例受試者使用了至少1劑本品,輸液的總次數為6775次。這項研究的主要安全性終點是對於本品FⅧ抑制物的發生率。上述94例患者中有2例患者(2.1%)出現了低滴度的一過性抑制物。
在一項臨床試驗中(研究301),101例既往未接受過治療的患者使用本品前一代產品治療後有32例(32%)出現抑制物:101例中有16例(16%)滴度 ] 5 Bethesda單位(BU),有16例(16%)滴度≤ 5 BU。這些患者中出現抑制物前的暴露天數中位值為12天(範圍:3~49天)。在16例高滴度(]5 BU)患者中,15例接受了本品前一代產品的免疫耐受(immune tolerance)治療,11例在免疫耐受處理後最近一次檢測時滴度[ 0.6 BU。在16例低滴度(≤ 5 BU)患者中,10例接受了本品前一代產品的免疫耐受治療,其中9例最近一次檢測結果[ 0.6 BU。因此,免疫耐受治療的總體有效性為80%(20/25),高應答者為73%,低應答者為90%。其餘6例沒有接受免疫耐受治療的低應答患者中有5例最近一次檢測結果[ 0.6 BU。
在自發性上市後報告中,有既往接受過治療的患者產生高滴度抑制物的報告。
抑制物發生率的貝葉斯(Bayesian)統計分析
在一項貝葉斯統計分析中,套用研究310的試驗結果,更新了本品之前的支持性試驗中得出的PTP結果。在該試驗中,110例受試者中觀察到1例新發抑制物,2例復發性抑制物。本品前代產品的經驗是113例PTP受試者中1例出現抑制物。此貝葉斯分析表明,該試驗人群(真實的)抑制物發生率的95 %上限的估計值為4.17 %(見表3)。
[u]上市後經驗 [/u]
本品上市後報告的不良反應:超敏反應(包括過敏性反應),抑制物的形成和治療反應不足。 因自發報告上述不良反應的人群數量不確定,故尚不能確切評估這些反應的發生頻率,也不能確定這些不良反應與藥物暴露的因果關係。
以下匯總了本品國外臨床研究300、301、306、307、310和311所有的不良反應。表2中不良反應發生率基於每次輸注藥物後的統計。
使用本品可能發生變態反應型超敏反應。超敏反應的表現可能包括蕁麻疹、全身性蕁麻疹、胸部壓迫感、哮鳴、低血壓和過敏性反應。
如果發生任何反應,認為與本品的給藥相關,應根據患者的反應降低靜脈注射速度或終止注射本品。
免疫原性(中和抗體)
甲型血友病患者可能產生中和因子Ⅷ的抗體(抑制物)。與所有凝血因子Ⅷ產品一樣,應當對患者的抑制物形成進行監測,套用Nijmegen改進的Bethesda分析,以Bethesda單位(BU)定量。此類抑制物的出現,可能表現為臨床反應不佳或出現非預期的血漿因子Ⅷ活性水平低下。此情況下建議與血友病專科聯繫。
臨床試驗期間和上市後收到的療效不足報告主要來源於預防使用的患者。產生了抑制物的患者曾報告過療效不足和/或因子Ⅷ恢復情況不佳的事件,但未發現抑制物的患者也出現過這些情況。療效不足表現為:特定關節出血、新發現的關節出血、其他出血或患者發現的新部位自發性出血。為了確保充分的治療反應,必須對每例患者進行個體化的遞增劑量並進行監測,尤其是在開始接受本品治療的初期。
在關鍵的III期臨床研究中(研究310),既往接受過治療的甲型血友病患者用本品進行常規預防和按需治療,94例受試者使用了至少1劑本品,輸液的總次數為6775次。這項研究的主要安全性終點是對於本品FⅧ抑制物的發生率。上述94例患者中有2例患者(2.1%)出現了低滴度的一過性抑制物。
在一項臨床試驗中(研究301),101例既往未接受過治療的患者使用本品前一代產品治療後有32例(32%)出現抑制物:101例中有16例(16%)滴度 ] 5 Bethesda單位(BU),有16例(16%)滴度≤ 5 BU。這些患者中出現抑制物前的暴露天數中位值為12天(範圍:3~49天)。在16例高滴度(]5 BU)患者中,15例接受了本品前一代產品的免疫耐受(immune tolerance)治療,11例在免疫耐受處理後最近一次檢測時滴度[ 0.6 BU。在16例低滴度(≤ 5 BU)患者中,10例接受了本品前一代產品的免疫耐受治療,其中9例最近一次檢測結果[ 0.6 BU。因此,免疫耐受治療的總體有效性為80%(20/25),高應答者為73%,低應答者為90%。其餘6例沒有接受免疫耐受治療的低應答患者中有5例最近一次檢測結果[ 0.6 BU。
在自發性上市後報告中,有既往接受過治療的患者產生高滴度抑制物的報告。
抑制物發生率的貝葉斯(Bayesian)統計分析
在一項貝葉斯統計分析中,套用研究310的試驗結果,更新了本品之前的支持性試驗中得出的PTP結果。在該試驗中,110例受試者中觀察到1例新發抑制物,2例復發性抑制物。本品前代產品的經驗是113例PTP受試者中1例出現抑制物。此貝葉斯分析表明,該試驗人群(真實的)抑制物發生率的95 %上限的估計值為4.17 %(見表3)。
[u]上市後經驗 [/u]
本品上市後報告的不良反應:超敏反應(包括過敏性反應),抑制物的形成和治療反應不足。 因自發報告上述不良反應的人群數量不確定,故尚不能確切評估這些反應的發生頻率,也不能確定這些不良反應與藥物暴露的因果關係。


禁忌
對本品任何成份過敏者禁用。
本品禁用於已知對製劑的任何成份有超敏反應史的患者和已知對倉鼠蛋白有超敏反應史的患者。
本品禁用於已知對製劑的任何成份有超敏反應史的患者和已知對倉鼠蛋白有超敏反應史的患者。
注意事項
[u]1. 一般注意事項 [/u]
患者對本品的臨床反應可能存在個體差異。若使用推薦的劑量未控制出血,應測定血漿中凝血因子Ⅷ水平,並給予足夠劑量的本品,以獲得滿意的臨床反應。若患者血漿因子Ⅷ水平未達到預期水平,或給予預期劑量後出血未控制,還應懷疑是否存在抑制物(中和抗體),並應做適當檢測。
[u]2. 過敏性反應和重度超敏反應 [/u]
使用本品可能發生變態反應型超敏反應。應當將超敏反應(包括蕁麻疹[皮疹伴瘙癢]、全身性蕁麻疹、胸部緊壓感、哮鳴和低血壓)和過敏性反應的早期症狀告知患者。
如果發生變態或過敏性反應,應當立即停用本品,並給予適當醫療處理,包括休克的治療。若出現上述症狀,根據反應的種類和嚴重程度,應建議停用本品,並進行緊急治療。
[u]3. 中和抗體[/u]
使用凝血因子Ⅷ產品的患者可能出現有活性的中和抗體(抑制物)。與使用所有凝血因子Ⅷ產品一樣,使用本品時應通過適當的臨床觀察或實驗室檢測,監測患者是否有抑制物形成。已有在使用本品後產生抑制物的報告。如果血漿中的因子Ⅷ活性未達到預期的水平,或在合適的劑量下出血沒有得到控制,則應測定是否存在因子Ⅷ抑制物。
在存在因子Ⅷ抑制物(尤其是高於5 BU的高滴度抑制物)的患者中,因子Ⅷ治療可能無效,應考慮換用其它治療方法。 抑制物在既往未接受過因子Ⅷ產品治療的患者中很常見,在既往接受過治療的患者中也有報告。
[u]4. 抗倉鼠蛋白抗體的形成 [/u]
本品含有痕量中國倉鼠卵巢細胞(CHO細胞)蛋白。在接受本品治療的患者中,可能會發生對該非人源哺乳動物蛋白的超敏反應。
[u]5.實驗室監測檢查 [/u]
·根據臨床指征,應使用一期法監測患者血漿的因子Ⅷ活性水平,以確定達到並維持足夠的因子Ⅷ水平。
·推薦根據臨床指征,使用因子Ⅷ活性恢復值和其它藥代動力學參數指導給藥劑量。
·監測因子Ⅷ抑制物的形成。如果血漿中的因子Ⅷ活性未達到預期的水平,或在合適劑量下出血沒有得到控制,則應測定是否存在因子Ⅷ抑制物,並採用Bethesda 單位 (BU)確定抑制物的滴度。
[u]6. 相容性 [/u]
在缺少相容性研究的情況下,復溶後的本品不能與其它藥品共用同一導管或容器給藥。
患者對本品的臨床反應可能存在個體差異。若使用推薦的劑量未控制出血,應測定血漿中凝血因子Ⅷ水平,並給予足夠劑量的本品,以獲得滿意的臨床反應。若患者血漿因子Ⅷ水平未達到預期水平,或給予預期劑量後出血未控制,還應懷疑是否存在抑制物(中和抗體),並應做適當檢測。
[u]2. 過敏性反應和重度超敏反應 [/u]
使用本品可能發生變態反應型超敏反應。應當將超敏反應(包括蕁麻疹[皮疹伴瘙癢]、全身性蕁麻疹、胸部緊壓感、哮鳴和低血壓)和過敏性反應的早期症狀告知患者。
如果發生變態或過敏性反應,應當立即停用本品,並給予適當醫療處理,包括休克的治療。若出現上述症狀,根據反應的種類和嚴重程度,應建議停用本品,並進行緊急治療。
[u]3. 中和抗體[/u]
使用凝血因子Ⅷ產品的患者可能出現有活性的中和抗體(抑制物)。與使用所有凝血因子Ⅷ產品一樣,使用本品時應通過適當的臨床觀察或實驗室檢測,監測患者是否有抑制物形成。已有在使用本品後產生抑制物的報告。如果血漿中的因子Ⅷ活性未達到預期的水平,或在合適的劑量下出血沒有得到控制,則應測定是否存在因子Ⅷ抑制物。
在存在因子Ⅷ抑制物(尤其是高於5 BU的高滴度抑制物)的患者中,因子Ⅷ治療可能無效,應考慮換用其它治療方法。 抑制物在既往未接受過因子Ⅷ產品治療的患者中很常見,在既往接受過治療的患者中也有報告。
[u]4. 抗倉鼠蛋白抗體的形成 [/u]
本品含有痕量中國倉鼠卵巢細胞(CHO細胞)蛋白。在接受本品治療的患者中,可能會發生對該非人源哺乳動物蛋白的超敏反應。
[u]5.實驗室監測檢查 [/u]
·根據臨床指征,應使用一期法監測患者血漿的因子Ⅷ活性水平,以確定達到並維持足夠的因子Ⅷ水平。
·推薦根據臨床指征,使用因子Ⅷ活性恢復值和其它藥代動力學參數指導給藥劑量。
·監測因子Ⅷ抑制物的形成。如果血漿中的因子Ⅷ活性未達到預期的水平,或在合適劑量下出血沒有得到控制,則應測定是否存在因子Ⅷ抑制物,並採用Bethesda 單位 (BU)確定抑制物的滴度。
[u]6. 相容性 [/u]
在缺少相容性研究的情況下,復溶後的本品不能與其它藥品共用同一導管或容器給藥。
孕婦及哺乳期婦女用藥
本品尚未進行動物生殖方面的研究。尚不清楚本品是否會對胎兒造成傷害,或是否會影響生殖能力。尚無關於因子Ⅷ替代治療對分娩影響的研究信息。尚不清楚本品是否會被分泌至人類乳汁中。
由於甲型血友病在女性中罕有發生,因此缺乏妊娠和哺乳期套用因子Ⅷ產品的經驗。只有在有明確指征時才能在妊娠女性和哺乳期女性中使用本品。
由於甲型血友病在女性中罕有發生,因此缺乏妊娠和哺乳期套用因子Ⅷ產品的經驗。只有在有明確指征時才能在妊娠女性和哺乳期女性中使用本品。
兒童用藥
本品在既往接受過治療的6歲以下患者中的研究正在進行中。
在7 例既往接受過治療的12~16歲患者中進行了本品藥代動力學研究。在這些患者中,藥代動力學參數與成人接受50 IU/kg一次給藥後的結果相似。
目前尚未獲得本品在中國兒童中使用的臨床研究數據。
在7 例既往接受過治療的12~16歲患者中進行了本品藥代動力學研究。在這些患者中,藥代動力學參數與成人接受50 IU/kg一次給藥後的結果相似。
目前尚未獲得本品在中國兒童中使用的臨床研究數據。
老年用藥
本品的臨床試驗尚未納入≥ 65歲受試者。總體而言,老年患者的劑量選擇應個體化。
藥物相互作用
尚不明確。
藥物過量
尚無重組凝血因子Ⅷ產品使用過量的相關症狀的報告。
臨床試驗
預防和按需治療的臨床試驗
在國外研究310中,受試者接受本品預防治療方案,並可根據臨床指征接受按需治療。試驗入選了94例受試者,並接受了至少一次給藥,所有受試者均被納入意向治療(ITT)人群中。94例接受治療受試者的年齡中位值為24歲(均數為27.7歲,範圍為12~60歲)。所有受試者的既往暴露日≥150,基線FⅧ活性水平≤ 2 %。89例受試者的治療暴露日≥50。
在評估安全性和療效的開放研究階段,所有94例受試者均接受了本品常規預防,劑量為30 ± 5 IU/kg, 每周3次,並可基於預先確定的標準劑量逐漸遞增。試驗過程中,有6例受試者接受了7次劑量遞增。94例受試者中的43例受試者(45.7 %)在接受常規預防時未報告出血。所有出血事件的年出血率的中位值(ABR) 為1.9 (均數 3.9,範圍0 ~42.1)。
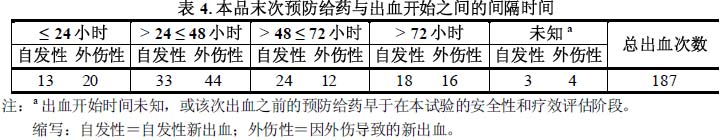
94例受試者中的53例受試者接受了本品的按需治療,總計治療了187次出血(見表4)。在這些出血中,有7次發生於轉換為預防治療方案前的受試者。180次出血中的110次(61.1 %)發生在末次給藥後≤48小時內,38.9 % (70/180次出血)發生在末次給藥後] 48小時。末次預防給藥後≤ 48小時內的大多數出血(64/110次出血,58.2 %)是外傷性的。末次預防給藥後] 48小時的出血中有60 %(42/70次出血)是自發性的。按需治療方案由研究者確定。按需治療的中位劑量為30.6 IU/kg(範圍6.4~74.4 IU/kg)。
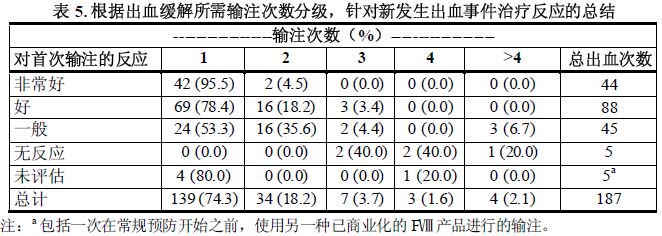
大多數(173/187; 92.5 %) 出血在1或2次輸注本品後緩解。受試者根據一個預先指定的4分止血效果量表對結果進行了評定。根據對初始治療反應的評價,在本品治療的187次出血中,有132次治療(70.6 %)評定為非常好或好;45次(24.1 %)評定為一般。5次 (2.7 %)評定為無反應,5 次(2.7 %)沒有評定。
預防手術出血的臨床試驗
在一項正在進行的、預防手術出血的開放試驗中,入組了至少25例重度或中重度(FⅧ:C ≤ 2%)甲型血友病PTPs患者,其中21例接受大手術的受試者套用了本品。1例受試者僅接受了手術前的本品藥代動力學評估,但未接受手術。
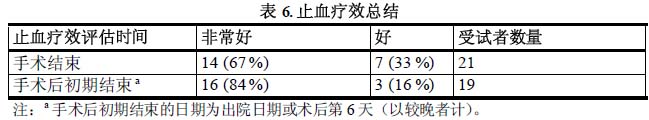
在25例可評估受試者中,針對21例患者進行了中期分析,他們接受的大手術包括13例全膝關節置換術、1例髖關節置換術、3例滑膜切除術、1例左側尺神經移位松解術、1 例腹疝修補手術/疤痕修補、1例膝關節鏡手術、1例全膝關節置換術後的膝關節修補和清創術。21例受試者在手術結束時及術後初期結束時,研究者對於所有療效評估均為非常好或好。除1例患者發生了醫源性出血外,其他所有患者在術中和術後階段失血均評定為正常。詳見下表6。
在國外研究310中,受試者接受本品預防治療方案,並可根據臨床指征接受按需治療。試驗入選了94例受試者,並接受了至少一次給藥,所有受試者均被納入意向治療(ITT)人群中。94例接受治療受試者的年齡中位值為24歲(均數為27.7歲,範圍為12~60歲)。所有受試者的既往暴露日≥150,基線FⅧ活性水平≤ 2 %。89例受試者的治療暴露日≥50。
在評估安全性和療效的開放研究階段,所有94例受試者均接受了本品常規預防,劑量為30 ± 5 IU/kg, 每周3次,並可基於預先確定的標準劑量逐漸遞增。試驗過程中,有6例受試者接受了7次劑量遞增。94例受試者中的43例受試者(45.7 %)在接受常規預防時未報告出血。所有出血事件的年出血率的中位值(ABR) 為1.9 (均數 3.9,範圍0 ~42.1)。
94例受試者中的53例受試者接受了本品的按需治療,總計治療了187次出血(見表4)。在這些出血中,有7次發生於轉換為預防治療方案前的受試者。180次出血中的110次(61.1 %)發生在末次給藥後≤48小時內,38.9 % (70/180次出血)發生在末次給藥後] 48小時。末次預防給藥後≤ 48小時內的大多數出血(64/110次出血,58.2 %)是外傷性的。末次預防給藥後] 48小時的出血中有60 %(42/70次出血)是自發性的。按需治療方案由研究者確定。按需治療的中位劑量為30.6 IU/kg(範圍6.4~74.4 IU/kg)。
大多數(173/187; 92.5 %) 出血在1或2次輸注本品後緩解。受試者根據一個預先指定的4分止血效果量表對結果進行了評定。根據對初始治療反應的評價,在本品治療的187次出血中,有132次治療(70.6 %)評定為非常好或好;45次(24.1 %)評定為一般。5次 (2.7 %)評定為無反應,5 次(2.7 %)沒有評定。
預防手術出血的臨床試驗
在一項正在進行的、預防手術出血的開放試驗中,入組了至少25例重度或中重度(FⅧ:C ≤ 2%)甲型血友病PTPs患者,其中21例接受大手術的受試者套用了本品。1例受試者僅接受了手術前的本品藥代動力學評估,但未接受手術。
在25例可評估受試者中,針對21例患者進行了中期分析,他們接受的大手術包括13例全膝關節置換術、1例髖關節置換術、3例滑膜切除術、1例左側尺神經移位松解術、1 例腹疝修補手術/疤痕修補、1例膝關節鏡手術、1例全膝關節置換術後的膝關節修補和清創術。21例受試者在手術結束時及術後初期結束時,研究者對於所有療效評估均為非常好或好。除1例患者發生了醫源性出血外,其他所有患者在術中和術後階段失血均評定為正常。詳見下表6。



藥理毒理
藥理作用
活化因子Ⅷ是活化因子IX的輔因子,可加快因子X轉化為活化因子X。活化的因子X可將凝血酶原轉化為凝血酶,凝血酶將纖維蛋白原轉化為纖維蛋白,纖維蛋白可形成不溶性凝塊。本品(注射用重組人凝血因子Ⅷ,BDDrFⅧ)是重組DNA產品,其功能特點與內源性因子Ⅷ相當。因子Ⅷ是甲型血友病(典型性血友病)患者缺乏的特異性凝血因子。本品給藥可升高因子Ⅷ的血漿水平,並可使這些患者的凝血缺陷得到暫時糾正。
毒理研究
重複給藥毒性
大鼠重複給藥試驗
SD大鼠(4/性別/組)接受本品0 (溶劑)、200、400、800、1600 IU/kg/天的每日一次靜脈給藥,給藥10或11天。本試驗的NOAEL(未觀察到毒性反應劑量)≥1600 IU/kg/天。
SD大鼠(10/性別/組)每日一次靜脈給予本品,劑量為0(溶劑)、50、250、1250 IU/kg/天,給藥4周。在本品給藥動物中,存在對本品的劑量相關性抗體誘導反應。在250和1250 IU/kg/天劑量組的少數動物中,APTT(活化部分凝血酶原時間)輕微延長。認為APTT的輕微延長繼發於抗BDDrFVIII抗體的應答反應,該應答反應可能會中和外源性重組人因子Ⅷ和大鼠內源性因子Ⅷ活性。此中和反應會導致APTT延長。本試驗的NOAEL≥1250 IU/kg/天。
猴重複給藥試驗
食蟹猴每天一次靜脈給予BDDrFVIII,劑量為0 (溶劑) (1/性別)、800 (2/性別)、1250 (2/性別) IU/kg/天,共給藥7天。在第7天,與既往未接受給藥的動物相比,4隻既往接受過給藥的動物中的3隻動物的血漿因子Ⅷ活性下降。這提示出現了抗體應答,使外源性重組人因子Ⅷ和猴內源性因子Ⅷ活性均受到中和。但在該試驗中,未對抗BDDrFVIII抗體進行檢測。本試驗的NOAEL≥1250 IU/kg/天。
食蟹猴(3/性別/組)靜脈給予本品 4周,劑量為0(溶劑)、50、250和1250 IU/kg/天。除進行了全面性臨床檢查、臨床實驗室檢查和屍檢外,還分別在試驗前、第13、20和28天,評估了因子Ⅷ的血漿活性;在試驗前和第28天,對抗本品抗體及其中和活性進行了檢測。試驗中發現1隻動物死亡,3隻因處於瀕死狀態而被處死。這些動物的死亡發生於計畫採血日(第20和第28/29天)或在採血日後不久,每隻動物的主要體徵是靜脈注射部位的出血和/或明顯貧血。與給藥相關的臨床體徵是廣泛性出血和靜脈注射部位瘀傷。2隻瀕死動物出現體重下降,1隻瀕死動物出現食物攝入下降。在250和1250 IU/kg/天劑量組的動物中,出現了劑量和時間依賴性抗BDDrFVIII抗體,並伴有APTT延長、紅細胞指數(PCV、Hb和RBC計數)下降,和因子Ⅷ血漿活性下降。
可觀察到的治療相關性病變僅限於靜脈注射部位及其它散在部位的出血,這些變化主要見於250和1250 IU/kg/天劑量組的動物。組織學方面的治療相關性變化包括靜脈注射部位及各種其它器官的出血,包括心臟、皮下組織、膀胱、脊椎管、骨骼肌、胃腸道和結締組織。心臟是出血和水腫這類組織學病變的易發部位,並可伴繼發性炎症及早期纖維化,有時與心肌退行性病變有關。
關於本試驗中所觀察到的所有不良影響,認為與對重組人因子Ⅷ和猴內源性因子Ⅷ的中和抗體應答有關。
中和抗體應答可導致獲得性血友病綜合徵,並易發多器官出血,以及死亡、垂死、貧血和出血誘發的炎症。本試驗的NOAEL為50 IU/kg/天。但在任何劑量下,均未觀察到與BDDrFVIII免疫原性無關的不良影響。
致突變試驗
BDDrFVIII靜脈給藥,劑量為2490、4980、9960 IU/kg/天,小鼠骨髓微核試驗結果為陰性。
局部耐受性試驗
在猴中開展的重複給予Xyntha試驗中,對局部注射部位進行了鏡檢評估。所有試驗動物,包括對照組的注射部位均可見紅斑。鏡檢結果:在接受Xyntha注射的動物中以及對照組動物中的注射部位,可見輕、中度血管周圍和血管嗜中性粒細胞浸潤性炎症和/或纖維化,並常伴有出血。接受Xyntha注射的試驗動物中,出血程度較對照組更重。
活化因子Ⅷ是活化因子IX的輔因子,可加快因子X轉化為活化因子X。活化的因子X可將凝血酶原轉化為凝血酶,凝血酶將纖維蛋白原轉化為纖維蛋白,纖維蛋白可形成不溶性凝塊。本品(注射用重組人凝血因子Ⅷ,BDDrFⅧ)是重組DNA產品,其功能特點與內源性因子Ⅷ相當。因子Ⅷ是甲型血友病(典型性血友病)患者缺乏的特異性凝血因子。本品給藥可升高因子Ⅷ的血漿水平,並可使這些患者的凝血缺陷得到暫時糾正。
毒理研究
重複給藥毒性
大鼠重複給藥試驗
SD大鼠(4/性別/組)接受本品0 (溶劑)、200、400、800、1600 IU/kg/天的每日一次靜脈給藥,給藥10或11天。本試驗的NOAEL(未觀察到毒性反應劑量)≥1600 IU/kg/天。
SD大鼠(10/性別/組)每日一次靜脈給予本品,劑量為0(溶劑)、50、250、1250 IU/kg/天,給藥4周。在本品給藥動物中,存在對本品的劑量相關性抗體誘導反應。在250和1250 IU/kg/天劑量組的少數動物中,APTT(活化部分凝血酶原時間)輕微延長。認為APTT的輕微延長繼發於抗BDDrFVIII抗體的應答反應,該應答反應可能會中和外源性重組人因子Ⅷ和大鼠內源性因子Ⅷ活性。此中和反應會導致APTT延長。本試驗的NOAEL≥1250 IU/kg/天。
猴重複給藥試驗
食蟹猴每天一次靜脈給予BDDrFVIII,劑量為0 (溶劑) (1/性別)、800 (2/性別)、1250 (2/性別) IU/kg/天,共給藥7天。在第7天,與既往未接受給藥的動物相比,4隻既往接受過給藥的動物中的3隻動物的血漿因子Ⅷ活性下降。這提示出現了抗體應答,使外源性重組人因子Ⅷ和猴內源性因子Ⅷ活性均受到中和。但在該試驗中,未對抗BDDrFVIII抗體進行檢測。本試驗的NOAEL≥1250 IU/kg/天。
食蟹猴(3/性別/組)靜脈給予本品 4周,劑量為0(溶劑)、50、250和1250 IU/kg/天。除進行了全面性臨床檢查、臨床實驗室檢查和屍檢外,還分別在試驗前、第13、20和28天,評估了因子Ⅷ的血漿活性;在試驗前和第28天,對抗本品抗體及其中和活性進行了檢測。試驗中發現1隻動物死亡,3隻因處於瀕死狀態而被處死。這些動物的死亡發生於計畫採血日(第20和第28/29天)或在採血日後不久,每隻動物的主要體徵是靜脈注射部位的出血和/或明顯貧血。與給藥相關的臨床體徵是廣泛性出血和靜脈注射部位瘀傷。2隻瀕死動物出現體重下降,1隻瀕死動物出現食物攝入下降。在250和1250 IU/kg/天劑量組的動物中,出現了劑量和時間依賴性抗BDDrFVIII抗體,並伴有APTT延長、紅細胞指數(PCV、Hb和RBC計數)下降,和因子Ⅷ血漿活性下降。
可觀察到的治療相關性病變僅限於靜脈注射部位及其它散在部位的出血,這些變化主要見於250和1250 IU/kg/天劑量組的動物。組織學方面的治療相關性變化包括靜脈注射部位及各種其它器官的出血,包括心臟、皮下組織、膀胱、脊椎管、骨骼肌、胃腸道和結締組織。心臟是出血和水腫這類組織學病變的易發部位,並可伴繼發性炎症及早期纖維化,有時與心肌退行性病變有關。
關於本試驗中所觀察到的所有不良影響,認為與對重組人因子Ⅷ和猴內源性因子Ⅷ的中和抗體應答有關。
中和抗體應答可導致獲得性血友病綜合徵,並易發多器官出血,以及死亡、垂死、貧血和出血誘發的炎症。本試驗的NOAEL為50 IU/kg/天。但在任何劑量下,均未觀察到與BDDrFVIII免疫原性無關的不良影響。
致突變試驗
BDDrFVIII靜脈給藥,劑量為2490、4980、9960 IU/kg/天,小鼠骨髓微核試驗結果為陰性。
局部耐受性試驗
在猴中開展的重複給予Xyntha試驗中,對局部注射部位進行了鏡檢評估。所有試驗動物,包括對照組的注射部位均可見紅斑。鏡檢結果:在接受Xyntha注射的動物中以及對照組動物中的注射部位,可見輕、中度血管周圍和血管嗜中性粒細胞浸潤性炎症和/或纖維化,並常伴有出血。接受Xyntha注射的試驗動物中,出血程度較對照組更重。
藥代動力學
在一項關鍵性交叉設計的臨床試驗中,30例既往接受過治療的患者[PTPs] (≥ 12歲) 單次輸注本品50 IU/kg,隨後注射另一種全序列重組因子Ⅷ(FLrFⅧ,Advate®)作為對照;或首先單次輸注FLrFⅧ,隨後再套用本品。採用一期法,測定了這兩種製品的血液內濃度。在平均Cmax和AUC∞方面,本品與FLrFⅧ比值的90%置信區間處於預先定義的界限內(80 %~125 %),證明本品與FLrFⅧ具有藥代動力學等效性。上述各組患者的本品藥代參數見表7。
此外,在本試驗中,25例PTPs患者接受劑量為50 IU/kg的本品單次注射,之後隨訪6個月。基線與第6個月比較,藥代動力學參數相似,表明本品的藥代動力學特點不存在時間依賴性變化;在本品的Cmax和AUC∞平均數值方面,第6個月與基線比值的90 %置信區間處於預先確定的界限內(80 %~125 %)。詳見下表7。
兒科人群(12~16歲)
在7 例既往接受過治療的12~16歲患者中進行了本品藥代動力學研究。在這些兒科患者中,藥代動力學參數與成人接受50 IU/kg一次給藥後的結果相似。7例患者平均(± SD) Cmax和 AUC∞分別為1.09 ± 0.21 IU/mL和11.5 ± 5.2 IU•h/mL,平均清除率和血漿半衰期分別為5.23 ± 2.36 mL/h/kg和8.03 ± 2.44小時(範圍3.52~10.6小時),平均K值和體內回收率分別為2.18 ± 0.41 (IU/dL) / (IU/kg) 和112 ± 23%。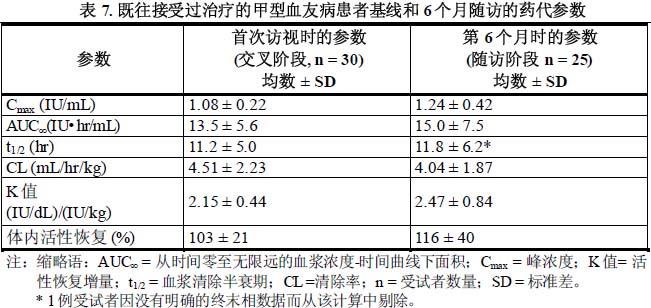
此外,在本試驗中,25例PTPs患者接受劑量為50 IU/kg的本品單次注射,之後隨訪6個月。基線與第6個月比較,藥代動力學參數相似,表明本品的藥代動力學特點不存在時間依賴性變化;在本品的Cmax和AUC∞平均數值方面,第6個月與基線比值的90 %置信區間處於預先確定的界限內(80 %~125 %)。詳見下表7。
兒科人群(12~16歲)
在7 例既往接受過治療的12~16歲患者中進行了本品藥代動力學研究。在這些兒科患者中,藥代動力學參數與成人接受50 IU/kg一次給藥後的結果相似。7例患者平均(± SD) Cmax和 AUC∞分別為1.09 ± 0.21 IU/mL和11.5 ± 5.2 IU•h/mL,平均清除率和血漿半衰期分別為5.23 ± 2.36 mL/h/kg和8.03 ± 2.44小時(範圍3.52~10.6小時),平均K值和體內回收率分別為2.18 ± 0.41 (IU/dL) / (IU/kg) 和112 ± 23%。

貯藏
於2~8 ℃避光保存和運輸。禁止冷凍。
包裝
本品包裝內含: 1瓶注射用重組人凝血因子Ⅷ凍乾粉; 1支預裝4 ml 0.9 % 氯化鈉稀釋液的注射器及推桿; 1個接合器; 1支無菌靜脈輸液針。
有效期
36個月。
執行標準
進口藥品註冊標準:JS20090091
生產企業
輝瑞投資有限公司
核准日期
2012年08月16日
