二元氫化物是一種新能源化合物。是由兩種元素組合而成的氫化物,是相對於氫化物(非二元或多元)存在的。其名稱構成是把兩種元素的名稱中加化學介字‘化’字綴合而成的。在名稱中,電負性較強的元素名稱放在前面,電負性較弱的元素名稱放在後面。
基本介紹
- 中文名:二元氫化物
- 類別:新能源化合物
ⅠA族二元氫化物,ⅡA族二元氫化物,ⅢA族二元氫化物,ⅣA族二元氫化物,ⅤA族二元氫化物,ⅥA族二元氫化物,ⅦA族二元氫化物,ⅠB族二元氫化物,ⅡB族二元氫化物,ⅢB族二元氫化物,鑭系,錒系,ⅣB族二元氫化物,VB族二元氫化物,Ⅷ族二元氫化物,
關於氫化物的一些問題
在元素教學中“氫化物”是一個不可迴避的內容,為說明元素周期律的指導意義也常用氫化物性質的遞變規律來加以佐證。但至今還是有一些涉及氫化物的問題沒有得到很好地解決,有必要加以討論與澄清。
一、有關“氫化物”名稱的兩種意見
對無機物進行科學命名,依據的只能是中國化學會制定的《無機物命名原則》(以下簡稱原則)。對所謂的“氫化物”來說也是這樣。但有關“氫化物”含義的兩種不同意見,似乎都可以在《原則》中找到自己的“根據”。
第一種意見是,在《原則》的“3.1二元化合物”中規定,“二元化合物的名稱是把兩種元素的名稱中加化學介字‘化’字綴合而成的。在名稱中,電負性較強的元素名稱放在前面,電負性較弱的元素名稱放在後面”。並舉例,稱HCl為氯化氫、稱LiH為氫化鋰、稱NaCl為氯化鈉、稱MgS為硫化鎂。
在無機和分析化學中也有類似的物質分類實例。有如MgS(硫化鎂)、CuS(硫化銅)、Ag2S(硫化銀)之類的化合物才屬於硫化物;而SO2(二氧化硫)、SF6(六氟化硫)是不包括在硫化物的範疇之內的。人們甚至歸納出這樣的判斷方法,可以由化合物名稱來區分出某物質是否屬於硫化物。即,它們都應該有形式如“硫化×”這樣的統一名稱,“硫”字在名稱中要在另一元素的前面。
這樣看,LiH的名稱為氫化鋰,應屬於氫化物。而HCl的名稱為氯化氫,屬於氯化物的範疇,不應稱之為“氫化物”。
也就是說,只有氫與電負性大的元素組成的二元化合物才能被稱為是“氫化物”。
第二種意見是,可以參照《原則》中僅有的兩個涉及二元化合物類別的標題來對這類氫的化合物來命名。其中的第一個例子就是直接給出了“3.2水溶液呈酸性的二元氫化物”這個標題,其中有HCl、H2S等例子。雖然在“氫化物”的前面加了一堆如“水溶液呈酸性”及“二元”等修飾性的定語,但名稱最終還是落實在“氫化物”三個字上。這實際上就是在肯定,HCl、H2S等都屬於氫化物。
再考慮到,在化學教學中,人們實際上已在廣泛地使用“離子型(鹽型)氫化物”、“共價型(分子型)氫化物”等這樣的術語。反過來還說“共價型(分子型)氫化物”不屬於“氫化物”,這不是有些過於“刻板”了。
應該承認,第一種意見帶有一些經驗性與推論性,只有參考的價值,是一個在某個範圍內才適用的說法。而第二種意見才是《規則》直接給出的,有依據的正統說法。
應統一認識,“氫化物”名稱代表的是所有含有氫元素的二元化合物,是“二元氫化合物”的簡稱。
二、關於鹽酸是不是電解質的問題
本人以前曾對這個問題進行過討論。但可能論述較為抽象,有人還覺得難於理解。正好又看到了《原則》中的有關段落,故摘錄下來(黑體字),順便再說幾句:
3.2水溶液呈酸性的二元氫化物
水溶液呈酸性的二元氫化物,除按一般二元化合物命名外,在水溶液中時,還可以視作無氧酸(也叫:氫酸),命名為氫某酸……”。
例:二元氫化物
化學式氣態純物質其水溶液
視作一般二元化合物視作無氧酸
H2F2氟化氫氫氟酸
HCl氯化氫氫氯酸、鹽酸
……
要注意這段文字的標題,是對二元氫化物來命名,是要對酸溶液中的溶質來命名。
套用這個規定,對鹽酸溶液中的溶質HCl,以下幾個名稱都是《規則》允許的:從一般二元化合物的角度叫“氯化氫”,從無氧酸的角度叫“氫氯酸”、“鹽酸”。在一般的情況下,這三個名稱可以被人們隨意選用。
這樣“鹽酸”就有了兩重含義。一是,代表氯化氫溶液,是一個混合物、是電解質溶液。其次,它也可以是該溶液中溶質HCl、這個二元氫化物的名稱。從後者這個狹義的內涵來看,鹽酸就是電解質。
三、氫化物的分類
按氫化物中鍵的性質、化合物性質的不同,氫化物可分為比較典型的三個類型:氫與非金屬元素形成的共價型氫化物(或稱分子型氫化物)、氫與鹼金屬或鹼土金屬元素組成的離子型氫化物(或鹽型氫化物)、及氫與過渡元素構成的金屬型氫化物(或間充氫化物)。當然,在這三個類型間,還會有一些具有過渡性質的氫化物。
在有的教材中還列出了“多聚型”,這一氫化物類別。所舉的例子有B2H6、NH2-NH2、PH2-PH2等(結構圖分別如下)。從它們的組成及性質來看,都屬於結構較為複雜的共價型氫化物。其複雜性都是由於另一元素的缺電子、或有相互成鍵的傾向而造成的,充其量只是共價型氫化物中的一個子類型。與一般須單獨研究的H2O2類似,它們沒有資格與另三種典型的氫化物類型並列。一般情況下,將氫化物分為共價型、離子型、金屬型來討論即可。
四、共價型氫化物
這是一類常見的、性質變化有規律可循的化合物。故常用其性質與元素周期系來相互佐證。常用到的性質與知識有幾下幾點:
1.組成情況
周期表中的P區元素的氫化物都屬於共價型氫化物。除ⅢA族外,其餘各族的中心原子都可以用最高負價與氫原子來構成氫化物。從而有通式RH8-n(n為主族元素的族數)。
2.結構特點
在這些共價型氫化物中,中心原子一律都採取sp雜化。當該氫化物屬於質子酸或質子鹼時,與其共軛的鹼離子或酸離子的中心原子仍保持sp雜化。如,H3O、NH4與NH2的中心原子也都採取sp雜化。
3.酸鹼性的變化規律及解釋
在同一主族中,隨原子序數的增加,氫酸的酸性逐漸增強。如對ⅦA族的HF、HCl、HBr、HI序列,其中HF的酸性是最弱的。在通常情況下,HF屬於弱酸,而其餘幾個氫化物則酸性依次增強,且都屬於強酸的範疇。
從分子結構角度對這一現象的解釋是,在同一主族中隨中心原子的電子層數增加,原子的共價半徑要逐漸加大,從而導致共價鍵的鍵長依次增大,鍵能依次變小,在水中電離也相對更為容易,故而酸性逐漸增強。對F原子來說,也是其特殊小的共價半徑,影響到H-F鍵的鍵能很大,才使其成為了弱酸。
化學熱力學分析結果也肯定,從HF到HI,離解焓(即鍵能)減小的速度是矛盾的主要方面,是影響氫化物酸性的最主要原因。但同時還指出,氫鍵存在(脫水時吸收的能量要更多),對HF的弱酸性也有不可忽略的影響。
在同一周期的主族元素中,隨原子序數增大氫化物的酸性會增強。如第二周期的NH3、H2O、HF,就是一個典型的“鹼性-中性-酸性”,酸性逐漸增強的變化序列。
從分子結構角度對這一現象的解釋是,在同一周期中隨中心原子的核電荷數增加,吸引電子的能力增強,鍵的極性要增大,從而與水分子作用解離成陰離子的趨勢變大,即酸性增強。
化學熱力學角度的解釋是,生成負離子的電子親和焓與負離子的水和焓起了決定性的作用。即,在F(g)→F(g)→F(aq)這個過程中,放出的能量會要更多,反應更容易進行,而表現出溶液的酸性更強些。對NH3則還要考慮其很大的質子親和焓(-866kJ·mol)的影響。
4.熱穩定性的變化規律及解釋
在一定的溫度下,氫化物能夠自身進行分解成組成元素單質(這個反應屬於氧化還原反應)。熱穩定性反映的就是個過程的難易程度。它當然要與分子中共價鍵的鍵能相關。因而有:
在同一主族中,隨原子序數的增加(如HF、HCl、HBr、HI)氫化物的熱穩定性要減弱;在同一周期中,隨原子序數增大(如NH3、H2O、HF),氫化物的熱穩定性要增強,這樣的規律性變化。
較為權威的解釋是,熱穩定性與中心原子的電負性有關。元素的電負性越大,與氫形成的氫化物的鍵能越大,生成焓越負,氫化物越穩定。
鍵能大小的比較,確實可以從成鍵原子的半徑、及原子的電負性,這樣兩個角度來度量。但在周期表同一主族的諸元素這中,似乎還是原子半徑(共價半徑)變化的規律性要更好一些。一般要用原子半徑來比較鍵能。但在上解釋中卻用電負性替代了原子半徑,可能還有其它的考慮。
5.還原性的變化規律及解釋
氫化物的還原性是指,在另一氧化劑作用下氫化物能失去電子,這樣的性質。更準確地說是指,在氧化劑作用下組成為的RH8-n的氫化物中,其(-8+-n)價的R原子或離子(在水溶液中)失去電子後重新又變為單質的過程。
顯然,(-8+-n)價的R原子或離子失去電子的能力與R的電負性及原子半徑有關。由於這兩者都隨元素周期表有周期性變化,所以氫化物的還原性也有周期性的變化:
在同一主族中,隨原子序數增大,原子半徑要增大,失電子能力變強,氫化物的還原性變強;
在同一周期中,隨原子序數增大,原子半徑會減小,失電子能力變弱強,氫化物的還原性減弱。
6.熔點與沸點的變化情況及解釋
分子型氫化物的熔沸點變化情況及解釋,在較高層次的無機化學教材中也只有三句話。即;
同周期元素氫化物的熔點和沸點依ⅢA-ⅥA逐漸升高。而ⅦA族則較低;
同族氫化物的熔點和沸點除NH3、H2O及HF外,隨原子序數增大而增高;
最後一句是,NH3、H2O及HF因分子間存在氫鍵,使它們有較高的熔點和沸點。
前兩句是描述熔沸點變化規律的,但都有例外。最後一句話是解釋,只提及了一個原因,即氫鍵對NH3、H2O及HF分子的影響。這裡是刻意地迴避了兩個問題:
一個是,為什麼在同周期中依ⅢA-ⅥA會有熔沸點的逐漸升高,在同主族中熔沸點隨原子序數增大而增高?
另一個是,與ⅥA族氫化物相比較,為什麼第ⅦA族相應氫化物的熔沸點反而要低一些?
其實在基礎化學範疇內,對分子型化合物熔沸點的不同,只能用分子間作用力的理論來討論。在一般情況下,分子間作用力主要來源於范德華力中的色散力。而色散力又與分子量有直接關係。所以用分子量大小,來作為判斷同主族或同周期氫化物熔沸點的高低變化,應該是相當有把握的:
在同一主族中,隨原子序數增大,氫化物的分子量增大,色散力增強,熔沸點要升高。這在下面的“氫化物的熔點變化示意圖”中每一主族(折線所示)的右三個氫化物中都是如此(單調上升)。第ⅤA、ⅥA、ⅦA族開始的NH3、H2O及HF,則是因為其分子間存在有氫鍵(氫鍵有更高的能量,破壞起來會更困難),而造成了熔點反常(不降反升)。這不是解釋的很好嗎?
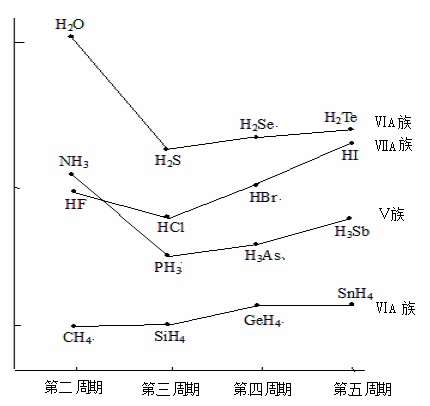
在同一周期中,隨原子序數增大,氫化物的分子量逐漸增大,色散力增強,熔沸點也要升高。這一規律在第三、四、五周期的ⅢA-ⅥA族元素間也有明顯的體現。如第三周期SiH4、PH3、H2S就是一個熔點逐漸升高的序列。只是最後的ⅦA族氫化物有“反常”行為。如HCl的沸點反而不如H2S高,HBr的沸點反而不如H2Se高。
當然,這個ⅥA與ⅦA族氫化物熔沸點整體“顛倒”的現象,恐怕目前也只能用分子間作用力的理論來解釋。
這樣,首先可以考慮的是,范德華力是由三部分,即取向力、誘導力、色散力組成的。用色散力解釋不了的問題,可能就是由於另外兩個力在起主導作用。
由於ⅥA與ⅦA族氫化物都是極性分子,極性分子相互間由於分子偶極須定向排列而產生取向力與誘導力。無疑分子的極性越強,其取向力與誘導力在分子間作用力中的比重或貢獻就越大。這樣定量反映分子極性的偶極矩就可能是度量分子間作用力大小的又有一個參數。
為此,查得ⅥA與ⅦA族氫化物分子的偶極矩如下(單位略去):
ⅦA族HCl(1.08)、HBr(0.82)、HI(0.44)
ⅥA族H2S(0.97)、H2Se(0.24)、H2Te(<0.2)
可見,這幾個第ⅦA族氫化物的偶極矩都要大於對應的ⅥA族氫化物的偶極矩,說明第ⅦA族氫化物分子間的取向力與誘導力都會更大,導致氫化物的熔點會更高。這表明,簡單用偶極矩解釋這種“反常”現象是行不通的。
解決問題的另一途徑,那就是應該再考察一下,取向力對色散力能否有影響,有什麼樣的影響(色散力是由於瞬時偶極產生的)?其實,憑物理方面的直覺我們也能想像出來,當分子的極性大、即該化合物中分子定向排列趨勢更大(取向力大)時,對瞬時偶極的產生及相互作用都是有相當大抑制作用的。即,對極性分子來說,其偶極矩的增大,有利於取向力與誘導力增大的同時,會削弱其色散力。
正好手頭有如下的數據(單位為kJ·mol):
分子 | 取向 | 誘導 | 色散 | 總和 |
H2O | 36.39 | 1.93 | 9.00 | 47.31 |
NH3 | 13.31 | 1.55 | 14.95 | 29.80 |
HCl | 3.31 | 1.00 | 16.83 | 21.14 |
HBr | 0.69 | 0.502 | 21.94 | 23.11 |
HI | 0.025 | 0.113 | 25.87 | 16.00 |
僅從第一、二行的數據就可以看出取向力對色散力的影響。比較同屬於第二周期的H2O與NH3,雖然H2O的分子量更大些,理論上似乎色散力也會更大些,但色散力的實測值卻遠小於NH3(僅為後者60%)。其原因就是H2O分子的極性及取向力都更大,使其色散力有較大幅度地減少。
可惜原表中可用的數據只有這些,沒有H2S的數據。但類比上一組數據,對同屬於第三周期的HCl與H2S進行猜測。就會有:雖然HCl的分子量更大些,但同時其極性及取向力也都更大,從而導致其色散力反而小於H2S,各種分子間作用力的總和也小於H2S,熔點也就不如H2S高了。
對同屬於第二周期的HF與NH3(注意中間隔了一個H2O)也類似的可以有:雖然HF的分子量更大些,但同時其極性及取向力也都更大,從而導致其色散力反而小於NH3,整個分子間作用力也小於NH3,熔點也不如NH3高。
可以更簡單地說,與第ⅥA族對應氫化物相比較,第ⅦA族氫化物中兩構成元素的電負性差值更大、分子的極性更強,在取向力與誘導力增強的同時,大大地削弱了分子間的色散力。從而導致ⅦA族氫化物比第ⅥA族對應氫化物的分子間作用力反而要更小,ⅦA族氫化物的熔沸點整體偏低。
當然,這種“解釋”還只能算是一個猜測,還需要實驗數據的支撐。
在用氫鍵來解釋NH3、H2O及HF熔沸點“反常”的現象時,還要注意一點,就是氫鍵對這三種氫化物的影響還有程度上的區別。換句話說,由於分子中的氫原子數目及孤電子對數目的不同,它們能形成的最多氫鍵數有別。
由於H2O分子的中心原子O在用sp雜化軌道與2個H原子成鍵後,還有2個孤電子對。這樣,在冰中每個水分子就能與另外的4個水分子形成4個氫鍵。而每個氫鍵被兩個水分子所共有,這樣平均每個水分子就可以獨立擁有2個氫鍵,即水分子數與氫鍵數為1:2,
對NH3與HF分子來說就不是這樣了。因為每個NH3分子雖然有3個H原子、但只有1個孤電子對,這就決定,平均每個NH3分子最多也只能有1個氫鍵;而每個HF分子雖然有3個孤電子對,但只結合有1個H原子,平均每個分子最多也只能有1個氫鍵。它們的分子數與氫鍵是之比都是1:1.
可見,氫鍵對水分子性質的影響要大的多。
六、離子型氫化物
通常都說第ⅠA與ⅡA族氫化物都是離子型氫化物。
其實,這是一種不夠嚴格的說法。因為LiH、MgH2、BeH2已有相當程度的共價性。其中BeH2的共價性尤為明顯,應歸類於多聚體共價鍵。
嚴格說,ⅠA族除Li外的其餘元素,ⅡA族的Ca、Sr、Ba元素的氫化物才是離子型氫化物。
在離子型氫化物中,氫以負離子(H)的形式存在。
氫負離子半徑隨陽離子極化力不同而有別,公認值為154pm。有意思的是這個值竟能大於一些第二周期簡單陰離子的半徑(如F為133pm、O為132pm)。
離子型氫化物的性質主要是氫負離子的還原性:
固態加熱條件下有反應:TiCl4+ 4NaH = Ti + 4NaCl + H2。
與水有反應:LiH + H2O = LiOH + H2、CaH2+ 2H2O = Ca(OH)2+ 2H2。
七、金屬型氫化物
是氫原子填充在金屬晶格的間隙之內而形成的。其組成不固定,通常是非化學計量的。
電鍍時金屬產生氫脆(金屬強度大大降低)的原因就是因為有金屬型氫化物生成。在高溫高壓下,氫氣可以穿透過某些鋼板。
LaNi5合金可用作儲氫材料的原因在於:在不高溫度和壓力下反應“LaNi5+3H2= LaNi5H6”就是可逆的。且儲氫量很大(數據如下表)。
儲氫形式 | 密度/(g/cm) | 儲氫量/(kg/m) |
鋼瓶中的氫氣(150atm)* | 極小 | 13.4 |
液態的氫氣 | 0.071 | 71 |
LaNi5H6 | 6.43 | 88 |
注:*為按理想氣體計算出來的。
可見,在LaNi5H6中儲存的H2,竟然比液態的氫氣還要多。
ⅠA族二元氫化物
Li+H2→LiH (反應溫度750℃)
H2+Li3N→LiH→LiH+NH3 (加熱條件下)
LiH+AlCl4→Li[AlH4]+LiCl (在乙醚中反應)
NaH+H2O→NaOH+H2↑
NaH+TiCl4→NaCl+Ti+H2↑
K+H2→KH (300℃,隔絕空氣)
Rb+H2→RbH (450℃,隔絕空氣)
Cs+H2 →CsH(580~620℃)
ⅡA族二元氫化物
Be+H2 →BeH2(反應溫度﹥1000℃)
Mg+H2 →MgH2(100-180℃)
MgH2 (過量)+AlCl3→Mg(AlH4)2
Ca+H2→CaH2 (400~500℃)
Sr+H2→SrH2 (400~500℃)
Ba+H2→BaH2 (180℃)
ⅢA族二元氫化物
BF3+LiH→B2H6+LiBF4
BF3+NaBH4→B2H6+NaBF4
I2+NabH4→B2H6+NaI+H2 (二甘醇二甲醚中反應)
B2H6+NaH→NaBH4
Na(l)+H2(g)+SiO2+Na2B4O7(s)→NaBH4(s)+Na2SiO3(s)
BCl3+LiBH4→B2H6+LiCl
B2H6+LiH→LiBH4(在乙醚中反應)
AlH3+GeCl4→H2+GeCl2+AlHCl2
GeCl4+LiAlH4→H2+AlH3+LiCl+GeCl2
InH3 暫無數據可查
ⅣA族二元氫化物
C+H2→CH4 (甲烷) (1200℃時發生反應)
Al4C3+H2O→CH4+Al(OH)3
CaC2+H2O→C2H2 (乙炔)+Ca(OH)2
Mg2Si+HCl→SiH4↑ (甲矽烷)+MgCl2
Si2Cl6+LiAlH4→Si2H6 (乙矽烷)+LiCl+AlCl3
SiH4→Si+H2 (400℃)
SiH4+O2→SiO2+H2O (燃燒)
SiH4+H2O→H2+SiO2.H2O (有鹼存在)
SiH4+H2O+AgNO3→Ag+SiO2+HNO3
SiH4+KMnO4→H2+H2O+MnO2+K2SiO3
GeCl4+LiAlH4→GeH4+LiCl+AlCl3
Zn+GeI4+H2SO4→GeH4
GeO+NaBH4→GeH4(棕色粉末)
GeH4→Ge+H2 (>280℃)
Ge-Ca(合金)+HCl+NaCl→GeH2 (黃色聚合物)
GeH2→ Ge+H2 (200℃,缺O2狀態)
GeH2 +Br2→GeBr4...(...表示還有其他生成物)
GeH2 +HCl→Ge+GeH4+Ge2H6(乙鍺烷,密度1.98,熔點-109℃,沸點29℃)+Ge3H8(三鍺烷,密度2.0,熔點-105.6℃,沸點110.5℃) (密度為標準條件下,下同)
GeH2+H2O2(過氧化氫)/+HNO3→GeO2...(有NH3存在)
GeH2+OHˉ(濃)→GeH4+Ge
Pb-Mg(合金)+H2O+H﹢→PbH4
ⅤA族二元氫化物
NH4Cl+Ca(OH)2→NH3↑+H2O+CaCl2
2NH3+2Na→2NaNH2 氨基化鈉 +H2(350℃)
拓展
NaNH2 (熔融)+N2O→NaN3 疊氮化鈉
KNH2+NHCl4 →NH3+KCl
N2H4+HNO2(亞硝酸)→HN3+H2O
NaNH2+C→Na2NCN(氰氨基化鈉)(加熱)
Na2NCN+C→NACN(氰化鈉)(加熱)
C+N2+Na2CO3→NACN (高溫)
NACN+HNO2→HCN...
H2NCN→ (CN)2NH(二氰胺)(122℃)
H2NCN≈≈≈(互化為)HN=C=NH 碳二亞胺
CNCl+NaOH→NaOCN 氰酸鈉
NACN+Br2→ CNBr (溴化氰)+NaBr(<20℃,ph<8.5)
CNBr +NaN3→ CNN3 (疊氮氰)(油狀液體)(在乙腈中,2h)
P2O3+H2O→PH3↑+H3PO4
PH4Cl+H2O→PH3+Clˉ+H3O﹢(水合氫離子)
PH4I+KOH→PH3+KI+H2O
H3PO2(次磷酸)+OHˉ→PH3+HPO3(2ˉ)
PH3+O2→H3PO4(150℃)
PH3+H2O+Ag﹢→(H﹢)+Ag↓+H3PO4
Ca2P3+H2O→Ca(OH)2+PH3↑+P2H4↑(聯磷,少量)(純品為白色液體)
P2H4+O2→P2O5+H2O
AsCl3+NaBH4→AsH3+NaCl+BCl3
AsH3+O2 →As2O3 +H2O
AsH3+AgNO3→Ag+As2O3+HNO3
AsH3+HOAsH2→AS2H4(固)+H2O
As2H4→AS2H2(固)+H2(低酸度時,較高濃度)
H2+Sb2O3→Sb+SbH3+H2O(350℃,25Mpa)
SbH3→Sb+H2(200℃)
SbH3+O2 →Sb+H2O
SbH3+Cl2→SbCl3+HCl
SbH3+KOH→K3Sb+H2O
Bi2O3+Zn+H2SO4(稀)→BiH3 鉍化三氫
Mg3Bi2+HCl→BiH3+MgCl2
BiCl3+LiAlH4→BiH3 (-110℃反應,熔點-67℃,沸點16.8℃)
BiH3+O2(H2O)→Bi...
BiH3+CuSO4→Cu...
BiH3+AgNO3→Ag...
BiH3+In(CH3)3(三甲基銦)→InBi+CH4
ⅥA族二元氫化物
H2+O2→H2O
Na2O2+H2SO4→Na2SO4+H2O2(0℃)
H2O2→H2O+O2
H2O2+Cl2→HCl+O2↑
H2O2+PbS→PbSO4+H2O
H2O2+KI+HCl→I2+H2O+KCl
H2O2+H2SO4+KMnO4→MnSO4+K2SO4+H2O+O2↑
FeS+(H﹢)→H2S↑+Fe(2﹢)
H2S→H2+S (300℃)
H2S+O2→SO2 / S+H2O
H2S+HNO3(濃)→H2SO4+NO2+H2O
Se+H2→H2Se 硒化氫
CdSe(硒化鎘)+(H﹢)→H2Se...
Al2Se3+H2O→H2Se+Al(OH)3
H2Se →Se+H2 (空氣中)
H2Se +O2→SeO2 /Se+H2O
H2Se +H2O→H2...
H2Se +ZnSO4→ZnSe 硒化鋅...
K2Te+(稀H﹢)→H2Te...
PbTe+HCl→H2Te+PbCl2(二氯化鉛,氯化亞鉛)
H2Te+Cd(2﹢)→CdTe 碲化鎘
ⅦA族二元氫化物
CaF2+H2SO4 (濃)→HF(氫氟酸)+CaSO4
Br2+P+H2O→HBr(氫溴酸)+H3PO3
Br2+H2O+SO2→HBr+H2SO4
I2+P+H2O→HI (氫碘酸)+H3PO3
ⅠB族二元氫化物
ⅡB族二元氫化物
ZnI2+LiAlH4→ZnH2+AlH3+LiI (-40℃,Et2O乙醚中反應)
LiAlH4+Cd(CH3)2 ( 二甲基鎘))→HCd 氫化鎘...(-78℃,Et2O)(0℃時分解)[最早由Glenn D. Barbaras在1951年報導。]
HgI2+LiAlH4→HgH2+AlH3+LiI (-131℃,THF)
ⅢB族二元氫化物
Sc+H2→ScH2(>450℃)
Y+H2→YH2(正心立方體結構) / YH3(六方晶體)
鑭系
Ce+H2 →CeH2(300℃,H2)
CeH2+H2O (沸)→Ce(OH)3+H2
CeO2+H2→CeH3+H2O (H2中加熱)
CeN+H2→CeH3+NH3 (加熱)
Ce+CH3Cl→CeH3...(500~600℃)
CeH3+O2→CeO2+H2O (自燃)
CeH3+HCl→CeCl3+H2
Nd(粉)+H2→NdH3 (220℃,石英管中)
錒系
Ac+(1+x/2)H2=AcH2(+x) 分子式尚未很確定(350℃)(面心立方結構,密度8.35)
Th+H2→ThH2 (500~800℃)
Pa+H2→PaH3 (250~300℃)
U+H2→UH3 氫化鈾(250℃)
U+H2O (沸)→UH3...
UH3+HF→UF4 四氟化鈾 +H2
UH3+BrH→UBr4 四溴化鈾 +H2
UH3+BrH→UBr3 三溴化鈾 +H2 (加熱)
UH3+HI→UI4 四碘化鈾 +H2
UH3+HI→UI3 三碘化鈾 +H2
UH3+H2S→US 一硫化鈾 +H2 (400~500℃,24h小時)
Np+H2→NpH3 (50℃)(黑色,片狀)
Pu+H2→PuH2
Pu+H2 →PuH3 (25~50℃)
Pu+H2O→PuH2 + PuO (慢)
Pu+H2O→PuH3+Pu2O3(慢)
Pu+H2O→PuH2+Pu4O10
Am+H2→AmH3 氫化鎇(六方晶,密度9.76)(71kpa氫氣壓下,100℃,40h)
ⅣB族二元氫化物
Ti+NH3 →TiH2...
TiO2+CaH2→TiH2...
Zr (海綿)+H2→ZrH2 氫化鋯 (900℃) (密度5.6)
Zr+CaH2→ZrH2 (600℃,H2流)
Hf+x/H2→HfHx (x=0~2.1)
VB族二元氫化物
V+H2→VH (體心四方晶格BCT)
VH+H2→VH2 (面心立方晶格FCC)
Nb (箔)+H2 →NbH2二氫化鈮(3mol/LH2SO4,陰極加氫)(黑灰粉末,立方面心)
NbH+O2 →Nb2O5...
NbH+S→NbS2...
NbH+Cl2→NbCl5...
Ⅷ族二元氫化物
Rh+xH2→RhHx
Pd+H2→Pd2H /Pd5H3
H2+FeCl2+C6H5MgBr→FeH2+C6H6+MgBrCl (ET2O)
H2+FeCl3+C6H5MgBr→Feh3+C6H6+MgBrCl (300~500℃)
Ni+H2→NiH / NiH2