常見乳蛋白
目前已通過牛奶生產出了多種級別和類型的乳蛋白製品,例如乳清蛋白、酪蛋白、酪蛋白酸鹽、濃縮乳蛋白以及一些特定用途的特殊蛋白混合物等。蛋白結構、帶電基團和電荷分布等都會因為蛋白種類的不同而產生差異。例如,酪蛋白是無規則的線性、鬆散的結構,而乳清蛋白則是緊實的球體結構。蛋白質結構形狀的差異會影響與其他分子之間的相互作用位點和結合的程度。
乳清蛋白
牛奶的組成中87%是水,13%是乳固體。而在乳固體 27%是乳蛋白質,原料乳中除了 pH 4.6 等電點處沉澱的酪蛋白之外的蛋白質統稱為乳清蛋白,占乳蛋白質的18%~20%。乳清蛋白是一組小而緊密的球狀蛋白,水合能力強,分散度高,在乳中呈典型的高分子溶液狀態,甚至在等電點時仍能保持分散狀態。乳清蛋白的主要組成是 α-乳白蛋白和 β-乳球蛋白,約占乳清蛋白的81%。
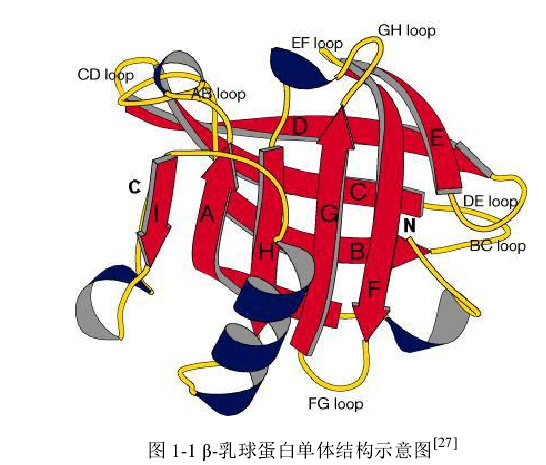
β-乳球蛋白(β-lactoglobulin,β-Lg)在乳清蛋白中占主要地位,它由162 個胺基酸組成,分子量約為 18.4 kDa,等電點為pH 5.2。β-Lg 以二聚體的形式存在於牛乳中,由非共價鍵連線2個單位亞基,該二聚體像一個拉長的橢圓體,長約6.95 nm,寬約3.60 nm。當 pH<3.5 或 pH˃8 時,β-Lg 解離,以單分子形式存在,每個單體含有 5 個半胱氨酸殘基,其中4個形成二硫鍵Cys 66-Cys 160和Cys l06-Cys 199,還有1個自由硫氫基Cys 121。β-Lg 是由八條反平行鏈(A-H)組成的 β 桶狀結構,由一些非常短的“loops”將 β-摺疊鏈連線起來,桶外有一個具有三個轉角的 α 螺旋和第九條 β 鏈。
α-乳白蛋白(α-lactoalbumin,α-La)由 123 個胺基酸組成,分子量為14.2 kDa,等電點約為pH 4.2。α-La 的8 個半胱氨酸殘基形成 4 個分子內二硫鍵,維持著它的空間結構。α-La 是金屬結合蛋白,其分子中有 4 個 Asp 可以結合1 分子的 Ca2+,在 pH 值小於5 的情況下,Asp 殘基質子化,失去結合Ca2+的能力。含 Ca2+的 α-La 熱穩定性高,變性後可復性,除去 Ca2+後,熱穩定降低,在很低的溫度下就可變性,變性後不再復性。
酪蛋白
酪蛋白(casein)是由 α-、β-和 κ-酪蛋白組成的一種含磷蛋白質,約占牛乳蛋白的80%,它的主要特徵是具有高含量的磷酸化絲氨酸殘基(SerP)和脯氨酸。 α-酪蛋白(包括 αs1-酪蛋白和 αs2-酪蛋白)和 β-酪蛋白為酪蛋白的主要組成成分,分別占酪蛋白的50%和 35%,並且它們的磷酸基團含量很高,不均勻地成簇分布在其序列中。這些磷酸化絲氨酸在酪蛋白膠束的結構上起到了關鍵的作用,因為它們能夠與鈣離子強烈地結合。κ-酪蛋白(κ-CN)是酪蛋白中含量最少,也是磷酸化水平最低的酪蛋白,僅有一個磷酸化絲氨酸殘基,因此對鈣最不敏感。雖然 κ-CN 含量少,但它對維持酪蛋白膠束結構的穩定起到至關重要的作用。酪蛋白膠束的模型主要有以下幾種:(1)核殼結構模型(coat-core models),該模型認為酪蛋白膠束的核心是由α-和 β-酪蛋白通過疏水作用結合成的球體顆粒,κ-酪蛋白則位於膠束的表面,構成膠束的外套;(2)亞單元結構模型(subunit models),該模型認為磷酸鈣連線起亞單位構成酪蛋白膠束,κ-CN 位於膠束表面,其極性的 C 端伸出膠體粒子進入周圍溶劑,對酪蛋白有空間穩定作用;(3)Holt 結構模型,認為酪蛋白膠束內部是由膠體磷酸鈣連線起來的單體酪蛋白分子組成的納米簇狀複合物,κ-CN位於酪蛋白膠束表面形成毛髮層維持膠體穩定性。X 射線小角衍射及多種相關實驗表明Holt 模型是當前關於酪蛋白膠束較為合理的結構模型。
影響乳蛋白穩定性的因素
一方面,蛋白質是兩性電解質,其中的酸性或鹼性胺基酸在一定pH 值下可發生解離帶上電荷,如酸性胺基酸包括天冬氨酸和谷氨酸,鹼性胺基酸包括賴氨酸、精氨酸和組氨酸。通常認為蛋白質吸附的主要動力就是靜電相互作用。蛋白質分子的伸展程度也是影響吸附的重要因素之一,因為蛋白質分子的伸展會使暴露出埋藏在內部更多的吸附位點。此外,還有蛋白質的大小及結構穩定性也會對其在固體表面的吸附產生影響。另一方面,對鈣鹽來說,它的表面形態及組成、表面均一性,表面疏水性及電位都會影響到對蛋白質的吸附。