基本介紹
- 中文名:三角雜化
- 含義:雜化後軌道的構型為三角
- 包含:sp2,sp3d
- 分別:平面三角型,三角雙錐
- 屬於:雜化軌道理論
理論說明,雜化軌道理論,
理論說明
(1)s-p型雜化
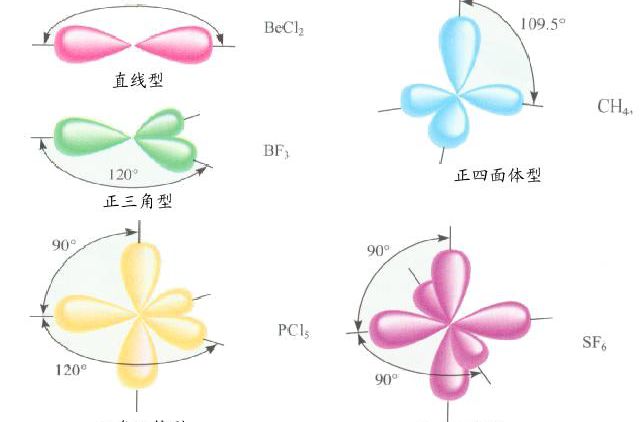
只有s軌道和p軌道參與的雜化,主要有以下三種類型:sp1雜化,sp2雜化 ,sp3雜化。
sp雜化軌道角度分布及其空間伸展方向示意圖
(2)s-p-d型雜化
ns軌道,np軌道,nd軌道一起參與雜化稱為s-p-d型雜化,主要有以下幾種類型:
sp3d雜化:由一個ns、三個np軌道和一個nd軌道雜化形成五個能量等同的sp3d雜化軌道。每個sp3d軌道都含有1/5個s、3/5個p和1/5個d成分。構型為三角雙錐。
sp3d2雜化:由一個ns、三個np軌道和二個nd軌道雜化形成六個能量等同的sp3d2雜化軌道。每個sp3d2軌道都含有1/6個s、1/2個p和1/3個d成分。構型為八面體。
此外還有以內層的(n-1)d軌道,ns軌道,np軌道一起參與的雜化方式,它主要存在於過渡金屬配位化合物中,例如d3sp3雜化、d2sp3雜化等。
(3)等性雜化和不等性雜化
雜化過程中形成雜化軌道可能是一組能量的並軌道,也可能是一組能量彼此不相等的軌道。因此,軌道的雜化方式可分為等性雜化和不等性雜化。
雜化軌道理論
hybrid orbital theory,是1931年由萊納斯·鮑林(Pauling L)等人在價鍵理論的基礎上提出的。雖然它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面豐富和發展了現代價鍵理論。
核外電子在一般狀態下總是處於一種較為穩定的狀態,即基態。而在某些外加作用下,電子也是可以吸收能量變為一個較活躍的狀態,即激發態。在形成分子的過程中,由於原子間的相互影響,單個原子中,具有能量相近的兩個能級中,具有能量較低的能級的一個或多個電子會激發而變為激發態,進入能量較高的能級中去,即所謂的躍遷現象,從而新形成了一個或多個能量較高的能級。此時,這一個或多個原來處於較低能量的能級的電子所具有的能量增加到與原來能量較高的能級中的電子相同。這樣,這些電子的軌道便混雜在一起,這便是雜化,而這些電子的狀態也就是所謂的雜化態。
用化學語言講,雜化軌道理論從電子具有波動性、波可以疊加的觀點出發,認為一個原子和其他原子形成分子時,中心原子所用的電子軌道不是原來純粹的s軌道或p軌道,而是若干不同類型、能量相近的電子軌道經疊加混雜、重新分配軌道的能量和調整空間伸展方向組成的同等數目的能量完全相同的新的電子軌道——雜化軌道,以滿足化學結合的需要。這一過程稱為電子軌道的雜化。
1、 某原子在成鍵時,在鍵合原子的作用下,同一原子中不同類型能量相近的原子軌道可能改變原有的狀態,混雜起來並重新組合成一組有利於成鍵的新軌道(即雜化軌道)。 這一過程稱為原子軌道的雜化,簡稱雜化。
2 、同一原子中能量相近的n 個原子軌道,組合後只能得到n個雜化軌道。例如,同一原子的一個ns 軌道和一個npx軌道,只能雜化成兩個sp雜化軌道。這兩個sp雜化軌道的形狀一樣,但其角度分布最大值在x軸上的取向相反。
3 、雜化軌道比原來未雜化的軌道成鍵能力強,形成的化學鍵鍵能大,使生成的分子更穩定。 由於成鍵原子軌道雜化後,軌道角度分布圖的形 狀發生了變化,形成的雜化軌道一頭大一頭小。大的一頭與別的原子成鍵時電子云可以得到更大程度的重疊 ,所以形成的化學鍵比較牢固。