簡介,活性氧的產生,線粒體中活性氧的產生,活性氧的測定方法,活性氧與線粒體凋亡通路,活性氧作用的靶標,生長因子等,蛋白酪氨酸激酶、轉錄因子等,蛋白激酶C,PI3K,Ca+/CaM,oxLDL,膠原合成,還原物,蛋白質、DNA,活性氧與細胞質Ca+水平,
簡介
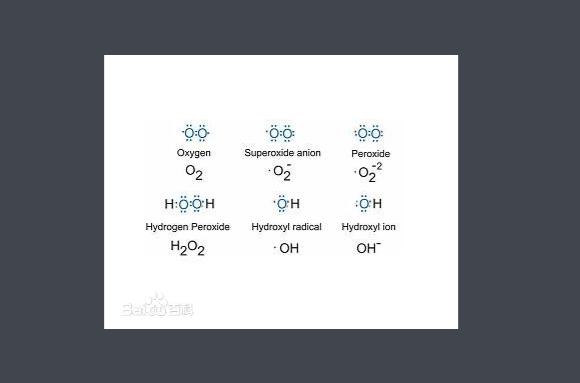
活性氧(reactive oxygen species,ROS)廣泛指代氧來源的自由基和非自由基,包含了超氧陰離子(O2-)、過氧化氫(H2O2)、羥自由基(OH-)、臭氧(O3)和單線態氧(1O2),由於它們含有不成對的電子,因而具有很高的化學反應活性。
在機體內,ROS的主要來源之一是線粒體內膜的呼吸鏈底物端,線上粒體中的電子傳遞鏈複合物將電子傳遞給O
2的過程中,有一部分O
2被還原,形成O2
-或H
2O
2。其中,最為重要的是O
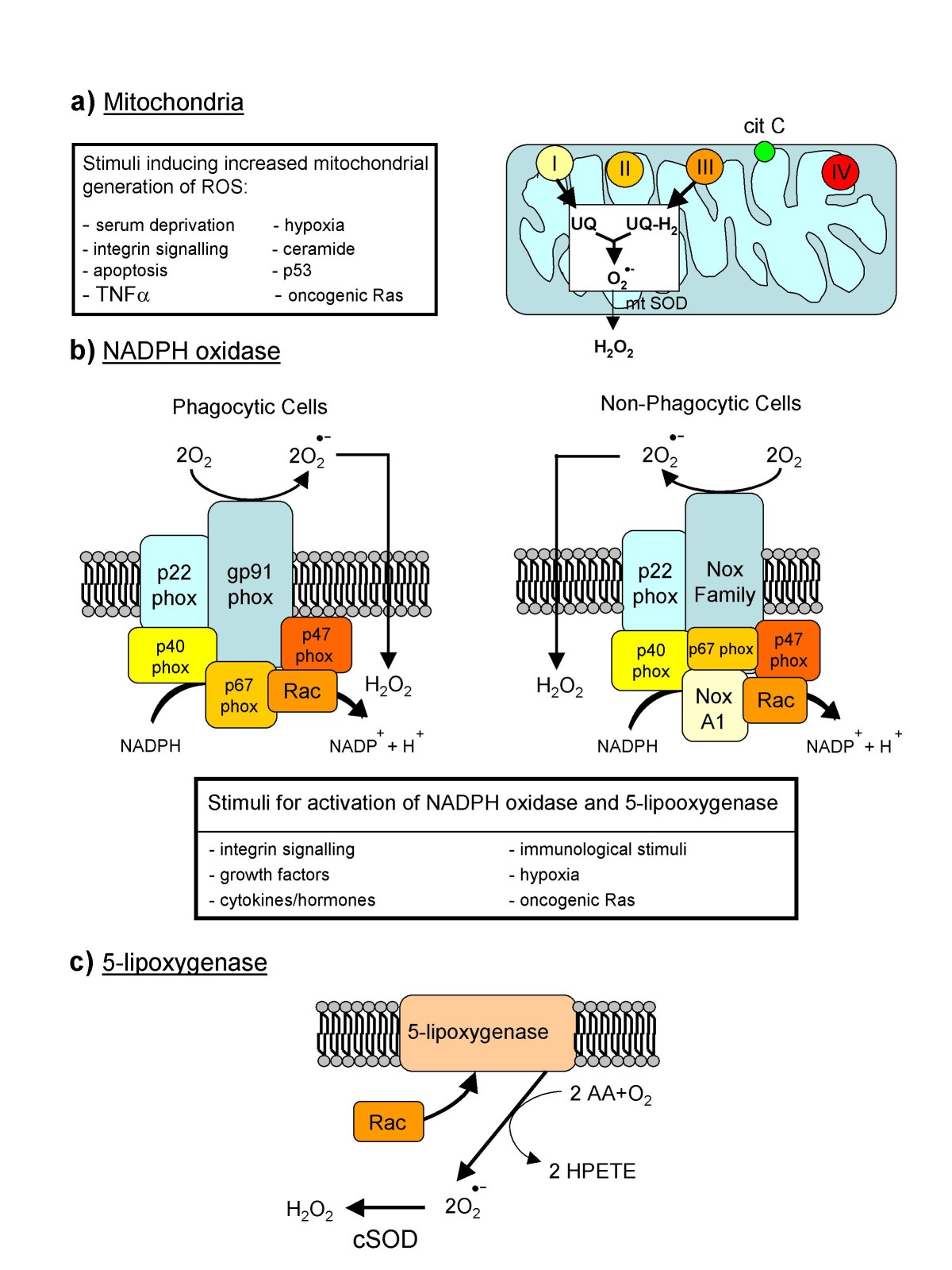
2-,它是大部分的ROS的前體,主要由線粒體內膜呼吸鏈中的蛋白酶複合體Ⅰ、Ⅲ產生。這部分作為代謝副產物的ROS長期被當作損傷生物大分子的毒性分子,但近年來被認為在較低水平時作為一類信號小分子具有生理作用,另一個ROS的重要來源是NADPH化酶,其催化亞基被稱為NADPH氧化酶2(NADPHoxidase2,NOX2/gp91
phax),能夠在細胞質膜上表達。在不同的組織中已經鑑定了6種NOX-2的同瀝物:NOX1,NOX3,NOX4,NOX5,DUOX1和DUOX2,統稱為NOX家族蛋白。這些酶能通過質傳遞電子產生ROS,可以大量存在於吞噬細胞,也在其他各種組織細胞中以較低水平普遍存在,參與很多膜受體下游信號激活。
 活非光合細胞中ROS的主要細胞來源
活非光合細胞中ROS的主要細胞來源活性氧的產生
活性氧(reactiveoxygenspecies,ROS)是O2,帶電子後的產物,包括氧的一電子產物氧負離子O2-、二電子產物過氧化氫(H2O2,)、三電子產物羥基自由基(OH-)、一氧化氮等,半衰期較短,脂溶性。體內活性氧主要是線上粒體電子傳遞鏈由Ⅲ狀態向狀態IV轉換中產生,線粒體高O2的環境,使高還原態的呼吸鏈有電子由呼吸鏈底物端和氧端漏出,並交給O2,而生成O2-。正常時,約2%的氧參與活性氧的產生;生理條件下,適量的活性氧可促進免疫、修復、存活、生長等。消除活性氧的抗氧化體系分為酶系和非酶系,酶系有超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GPx)等,非酶系主要是還原型谷胱甘肽(GSH)、維生素C/E等。細胞內高水平谷胱甘肽GSH,CAT(H2O2酶)、谷胱甘肽過氧化物酶(GPx)、超氧化物歧化酶SOD、環孢素、抗凋亡因子Bcl-2,可下調活性氧的產生水平。
線粒體中活性氧的產生
體內90%以上的O2,線上粒體中被消耗。O2一方面作為呼吸鏈的終端電子受體參與產生ATP的氧化磷酸化反應,維持能量代謝;另一方面,O2通過一系列化學反應,有時可生成氧自由基、活性氧(ROS)、活性氮(RNS)、脂類(RH)過氧化物等,脂類過氧化物有烷氧基(RO-)/烷過氧基(ROO-)/氫過氧化物(ROOH)等。線粒體產生活性氧的速率,受線粒體內膜跨膜電位的調節。線粒體呼吸鏈複合物Ⅰ的異咯秦半醌(FAD)、泛醌、複合物Ⅲ的細胞色素b566、輔酶Q氧化時漏電子,可產生活性氧;線粒體NADPH氧化酶和黃嘌呤氧化酶可催化生成O2-,線粒體的髓過氧化物酶MPO可催化生成OH-,線粒體蛋白激酶C可催化生成H2O2。
線粒體受外界因素刺激時,包括射線、高壓氧、香菸煙霧、空氣污染、鉛、鉻、釩、抗癌藥、抗生素、殺蟲劑、麻醉藥、高血糖、炎症因子、腫瘤壞死因子TNF-a/MLR(microcystin)、高血脂、缺血、乙醛、缺氧等,活性氧產生明顯增加。血管內皮生長因子受體、轉化生長因子B受體、胰島素樣生長因子受體、胰島素受體、血管緊張素受體ATIR、瘦素受體通路等高度活化時,也可使活性氧產生明顯增加。
活性氧的測定方法
在生物系統中,游離活性氧星很低,因此測定時需要靈敏的方法如脈衝射解、電子自旋共振等技術,但儀器較昂貴。由線粒體產生的H2O2,存在時間較長,能使DCFH探針的螢光物被氧化成DCF(二氯螢光素雙乙酸鹽),DCF可被酯酶裂解成二氯螢光素,以二氯螢光素為基礎的螢光法,可檢測H2O2、O2-和OH-,這種方法較簡單,但特異性較低。以亞鐵血紅素過氧化物酶/辣根過氧化物酶催化H2O2氧化螢光物、產生螢光素的螢光法,特異性和靈敏度較高;通過測定活性氧損傷的產物如脂質過氧化物(oxLDL)和DNA損傷產物(8-羥基鳥嘌呤)等,可間接反映活性氧產量。不成對電子使H2O2,等帶有順磁共振特性,可被EPR光譜法測量,但需要特殊的設備。使用氧化還原反應中分子間能量轉移,使發光氨還原後可與O2-,反應產生產物並發光,這種方法非常靈敏,已經用於測定完整細胞、單獨的線粒體及線粒體亞顆粒中的O2-含量。
活性氧與線粒體凋亡通路
線粒體是過量的活性氧主要的促調亡靶,可誘導線粒體雙層膜通透孔(PT孔)開放,釋放鈣離子、細胞色素C、凋亡誘導因子AIF,引起胱冬蛋白酶caspase9激活caspase3/6/7;可使線粒體電子傳遞鏈解耦聯,下調ATP產生水平,上調促凋亡蛋白Bax的表達水平,最後使線粒體外膜破裂,導致細胞凋亡。
線粒體雙層膜通透孔有2個氧化敏感位點:一個位點有吡啶核苷酸結合基序,可結合NAD/NADH和NADP+/NADPH;另一個位點有谷胱甘肽結合基序,可結合谷胱甘肽。活性氧能使線粒體雙層膜通透孔結合的NADH,NADPH、谷胱甘肽氧化,促使線粒體雙層膜通透孔開放。活性氧增加既是線粒體雙層膜通透孔開放的原因,也是其結果。高水平腫瘤壞死因子TNF-a/MLR可上調活性氧的產生水平。高水平活性氧也可刺激死亡受體通路,引起細胞凋亡。過量的活性氧也可誘導線粒體外膜孔開放,釋放鈣離了、細胞色素C、凋亡誘導因了AIF,引起細胞凋亡。
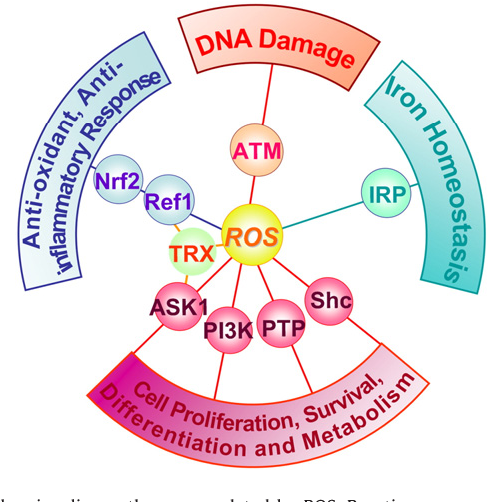
活性氧作用的靶標
過量的活性氧可與線粒體電子傳遞鏈多種蛋白硫氧還中心的Fe-S簇的Cys殘基反應,形成蛋白的S-谷胱甘肽化的加合物。過量的活性氧,可損傷生長因子、轉錄因子、蛋白質、核酸、糖類、脂類等。
生長因子等
適量的活性氧可通過活化表皮生長因子受體EGFR,激活磷脂酶PLA2/PLD,分解膜磷脂產生甘油二酯、三磷酸肌醇,活化蛋白激酶C,使DNA依賴的蛋白激酶和DNA斷端結合蛋白形成的複合體增加,促進對DNA雙鏈斷裂的修復,促進細胞存活。
活性氧過度產生時,可促使磷酸酶PTPIB、PTEN、細胞周期相關蛋白cde25失活,促進蛋白酪氨酸激酶PTK過度磷酸化活化,可促進NADPH氧化酶產生大量活性氧,過度活化鈣離於/鈣調蛋白激酶CaMK,引起生長抑制蛋白p21,p27表達水平上調,使生長因子、轉錄因子AP-1/c-Myb/Sp-1/EGR-1等降解、細胞骨架形成障礙、細胞周期停滯、生長受抑,促進細胞凋亡。
蛋白酪氨酸激酶、轉錄因子等
適量的活性氧可激活非受體酪氨酸激酶Src等,再通過結合下游信號蛋白,激活Ras/蛋白激酶MAPK.使轉錄因子磷酸化,促進靶基因表達、但活性氧過度產生時,使Src/Ras/蛋白激酶p38MAPK和蛋白激酶JNK過度激活,能氧化損傷轉錄因子cMyb、Sp-1、EGR-1、缺氧誘導因子HIF-1、cFos,cJun、AP-1等的半胱氨酸-SH基,使它們喪失與靶基因啟動子的結合力,抑制靶基因表達,促進細胞凋亡。
蛋白激酶C
適量的活性氧可激活蛋白激酶C,引發一系列蛋白質磷酸化,促進細胞增殖;高濃度的活性氧使蛋白激酶C過度活化,可使胱冬蛋白酶caspase依賴的凋亡通路活化,促細胞凋亡。
PI3K
適量的活性氧可激活蛋白激酶PI3K信號通路,抗輻射。活性氧過度產生時,過度上調蛋白激酶P13K/Akt的水平,可引發放射線照射後的細胞凋亡。活性氧過度產生時,也可與Fe2+進行自由基反應,產生毒性OH-,可造成DNA突變、斷裂,促進細胞凋亡。
Ca+/CaM,oxLDL
活性氧過度產生時,能氧化鈣調蛋白CaM的Met殘基,使之持續活化,可過度激活鈣調蛋白激酶CaMK,促細胞凋亡。活性氧過度產生時,能氧化產生氧化型低密度脂蛋白oxLDL,並通過清道夫受體LOX-1,上調促凋亡因子p53,Bax的表達水平;能使抗氧化酶如SOD,CAT,GPx的Cys殘基,形成二硫鍵而失活,降低細胞抗氧化力;也可使端粒酶活性下降,抑制細胞生長;也能上調凋亡誘導因子AIF活性,使PGC1a/鋅結合蛋白KEAPI/核受體因子NRF2/鈣離子/鈣調蛋白激酶/叉頭盒蛋白FoxO通路持續活化,促進細胞凋亡。
膠原合成
活性氧過度產生時,還可經轉錄因子Smad2/3、蛋白激酶ERK1/2、黏附斑激酶FAK、蛋白激酶P13K/Akt、蛋白激酶p38MAPK、蛋白激酶C8、核因子NF-kB等,促進膠原合成,促進纖維化。
還原物
與細胞外環境相比,細胞質通常處在還原狀態,這由細胞內的疏基化合物的還原能力來維持,主要有谷胱甘肽、維生素C/E、硫氧還蛋白(TRX),可下調H2O2,和脂質過氧化物的水平,抑制細胞的氧化應激。活性氧過度產生時,可引起還原物谷胱甘肽、維生素C/E、硫氧還蛋白的耗竭,增加細胞對活性氧的敏感度。
蛋白質、DNA
活性氧過度產生時,可誘導大分子發生氧化反應,氧化蛋白質的Ser和Cys殘基上的功能基團,引起構型、信號改變;可使核因子NF-kB、蛋白激酶C催化結構域內Cys殘基形成二硫鍵,上調NF-kB,蛋白激酶C的活性,催化產生H2O2,活性氧過度產生時,也可直接氧化、活化缺氧誘導因子HIF-1中的Cys殘基,促進炎症及凋亡;能氧化某些酶中的[4Fe2+-4S]中心,導致Fe2+的釋放,Fe2+可經Fenton反應產生大量活性氧;Fe2+的釋放也可引起某些金屬蛋白質失活。活性氧過度產生時,也可氧化信號分子、細胞因子、蛋白質、核酸、糖類、脂類等,使之受損。
活性氧與細胞質Ca+水平
活性氧過度產生時,通過上調三磷酸肌醇,使胞內的內質網膜三磷酸肌醇受體-鈣離子通道開放,內質網鈣庫釋放鈣離子,細胞質高水平鈣離子/鈣調蛋白激酶CaMK,可使質膜L型電壓門控鈣離子通道開放,胞外鈣離子流入,可誘發線粒體雙層膜通透孔開放,使線粒體腫脹、破裂,線粒體膜間腔鈣庫釋放鈣離子,可使細胞質Ca2+超載,活性氧大量產生。
胞質高水平鈣離子可活化蛋白激酶JNK/FoxO及巨噬細胞刺激因子MST1/FoxO等信號通路,促細胞凋亡;可使鋅結合蛋白KEAP1的Cys151/273/288殘基被氧化、活化,可釋放Zn2+並抑制核受體因子NRF2,並經Ⅱ相異生化酶、缺氧/UV輻射相關蛋白等,阻斷DNA修復,促細胞凋亡。近年發現活性氧的信號通路可被氧化磷酸化的解耦聯劑FCCP阻斷,並減少胞質鈣離子。
 ROS作用靶標
ROS作用靶標
 活非光合細胞中ROS的主要細胞來源
活非光合細胞中ROS的主要細胞來源 ROS作用靶標
ROS作用靶標