化學物質
分子式
C18H16BrN5S
分子量
414.32
CAS號
298-93-1
MTT用途及原理
MTT主要有兩個用途:
1.藥物(也包括其他處理方式如放射線照射)對
體外培養的細胞毒性的測定;
2.細胞增殖及細胞活性測定。
MTT原理:
檢測原理為活細胞
線粒體中的
琥珀酸脫氫酶能使外源性MTT還原為水不溶性的藍紫色結晶甲臢(Zā)(Formazan)並沉積在細胞中,而死細胞無此功能。二甲基亞碸(DMSO)能溶解細胞中的甲臢(Zā),用酶標儀在490nm波長處(英文說明書寫的是570nm)測定其光吸收值,在一定細胞數範圍內,MTT結晶形成的量與細胞數成正比。根據測得的
吸光度值(OD值),來判斷活細胞數量,OD值越大,細胞
活性越強(如果是測藥物毒性,則表示藥物毒性越小)。
實驗方法
明確問題
1. 選擇適當的細胞接種濃度。一般情況下,96孔培養板的一內
貼壁細胞長滿時約有10
5個細胞。但由於不同細胞貼壁後面積差異很大,因此,在進行MTT試驗前,要進行預實驗檢測其貼壁率、倍增時間以及不同接種細胞數條件下的
生長曲線,確定試驗中每孔的接種細胞數和培養時間,以保證培養終止致細胞過滿。這樣,才能保證MTT結晶形成數量與細胞數呈的
線性關係。否則細胞數太多敏感性降低,太少觀察不到差異。
2. 藥物濃度的設定。一定要多看文獻,參考別人的結果再定個比較大的範圍先初篩。根據自己初篩的結果縮小濃度和時間範圍再細篩。切記!否則,可能你用的時間和濃度根本不是藥物的有效濃度和時間。
3. 時間點的設定。在不同
時間點的測定OD值,輸入excel表,最後得到不同時間點的抑制率變化情況,畫出變化的曲線,曲線什麼時候變得平坦了(到了平台期)那個時間點應該就是最好的時間點(因為這個時候的細胞增殖抑制表現的最明顯)。
4. 培養時間。200ul的
培養液對於10的4-5次方的增殖期細胞來說,很難維持68h,如果營養不夠的話,細胞會由增殖期漸漸趨向G0期而趨於靜止,影響結果,我們是在48h換液的。
5. MTT法只能測定細胞相對數和相對活力,不能測定細胞絕對數。做MTT時,儘量無菌操作,因為細菌也可以導致MTT比色OD值的升高。
6. 理論未必都是對的。要根據自己的實際情況調整。
7. 實驗時應設定調零孔,對照孔,加藥孔。調零孔加培養基、MTT、二甲基亞碸。對照孔和加藥孔都要加細胞、培養液、MTT、二甲基亞碸,不同的是對照孔加溶解藥物的介質,而加藥組加入不同濃度的藥物。
8. 避免血清干擾。用含15%
胎牛血清培養液培養細胞時,高的血清物質會影響試驗孔的光吸收值。由於試驗本底增加,會試驗敏感性。因此,一般選小於10%胎牛血清的培養液進行。在呈色後,儘量吸淨培養孔內殘餘培養液。
 mtt
mtt步驟把握
MTT溶液的配製方法
通常,此法中的MTT濃度為5mg/ml。因此,可以稱取MTT 0.5克,溶於100 ml的磷酸緩衝液(PBS)或無酚紅的培養基中,用0.22μm濾膜過濾以除去溶液里的細菌,放4℃避光保存即可。在配製和保存的過程中,容器最好用鋁箔紙包住。
需要注意的是,MTT法只能用來檢測細胞相對數和相對活力,但不能測定細胞絕對數。在用酶標儀檢測結果的時候,為了保證實驗結果的線性,MTT 吸光度最好在0-0.7範圍內。
MTT一般最好現用現配,過濾後4℃避光保存兩周內有效,或配製成5mg/ml保存在-20度長期保存,避免反覆凍融,最好小劑量分裝,用避光袋或是黑紙、錫箔紙包住避光以免分解。我一般都把MTT粉分裝在EP管里,用的時候現配,直接往培養板中加,沒必要一下子配那么多,尤其當MTT變為灰綠色時就絕對不能再用了。
MTT有致癌性,用的時候小心,有條件最好帶那種透明的簿膜手套,配成的MTT需要無菌,MTT對菌很敏感;往96孔板加時不避光也沒有關係,畢竟時間較短,或者你不放心的時候可以把操作台上的照明燈關掉。
配製MTT時用用PBS溶解,也有人用生理鹽水配,60℃水浴助溶。
PBS配方:
Nacl 8g
Kcl 0.2g
Na2HPO4 1.44g
KH2PO4 0.24g
調pH 7.4
定容1L
貼壁細胞
1. 收集對數期細胞,調整細胞懸液濃度,每孔加入100ul,鋪板使待測細胞調密度至1000-10000孔,(邊緣孔用無菌PBS填充)。
2. 5%CO2,37℃孵育,至細胞單層鋪滿孔底(96
孔平底板),加入濃度梯度的藥物,原則上,細胞貼壁後即可加藥,或兩小時,或半天時間,但我們常在前一天下午鋪板,次日上午加藥。一般5-7個梯度,每孔100ul,設3-5個復孔,建議設5個,否則難以反應真實情況。
3. 5%CO2,37℃孵育16-48小時,倒置顯微鏡下觀察。
4. 每孔加入20ulMTT溶液(5mg/ml,即0.5%MTT),繼續培養4h。若藥物與MTT能夠反應,可先離心後棄去培養液,小心用PBS沖2-3遍後,再加入含MTT的培養液。
5. 終止培養,小心吸去孔內培養液。
6. 每孔加入150ul二甲基亞碸,置搖床上低速
振盪0.5min,使結晶物臢(Zā)充分溶解。在酶聯免疫檢測儀OD 560nm處測量各孔的吸光值。
7. 同時設定調零孔(
培養基、MTT、
二甲基亞碸),對照孔(細胞、相同濃度的藥物溶解介質、
培養液、MTT、二甲基亞碸)。
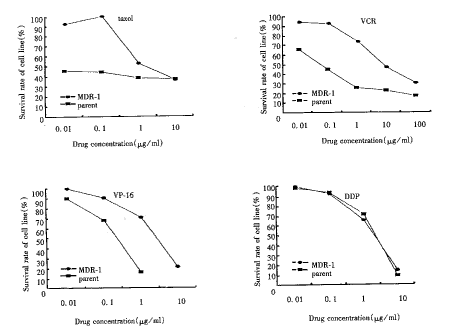 mtt
mtt懸浮細胞
1. 收集對數期細胞,調節細胞懸液濃度1×106/ml,按次序將:①補足的1640(無血清)培養基40ul;②加Actinomycin D(有毒性)10ul用培養液稀釋(儲存液100mg/ml,需預試尋找最佳稀釋度,1:10-1:20);③需檢測物10ul;④細胞懸液50ul(即5×104cell/孔),共100ul加入到96孔板(邊緣孔用無菌水填充)。每板設對照(加100ml 1640)。
2. 置37℃,5%CO2孵育16-48小時,倒置顯微鏡下觀察。
3. 每孔加入10ul MTT溶液(5 mg/ml,即0.5%MTT),繼續培養4h。(懸浮細胞推薦使用
WST-1,培養4h後可跳過步驟4,直接酶聯免疫檢測儀OD 560nm(630nm校準)測量各孔的吸光值)。
4.
離心(1000轉x10min),小心吸掉上清,每孔加入100ul
二甲基亞碸,置搖床上低速
振盪10min,使結晶物充分溶解。在酶聯免疫檢測儀OD 560nm(630nm校準)測量各孔的吸光值。
接種(鋪板)
細胞過了30代以後就不要用了,因為狀態不好了;培養板要用好的(最好進口板),不好的板或重複利用的板只可做預實驗。
接種時最好按照預實驗摸索出的密度接種,因為細胞密度在10000/ml左右時,所測得的OD值的區間即細胞抑制率(或者增值率)的所呈現的線性關係最好,結果最可信。如果鋪的太稀細胞的殺傷不會很明顯,太密細胞可能都會凋亡,因為細胞長的太快營養會不夠,最後導致死亡。且而細胞過密或者過少,增殖都會過快或者過慢,其增值率
線性關係不佳。故而MTT細胞密度多採用10000/ml,100ul/孔。
細胞密度要根據不同細胞的特點來定。如果你做的藥品對細胞具有刺激作用那么取小點的細胞濃度,如果你做的藥品對細胞具有抑制作用那么取大點的細胞濃度,這樣與對照的區別更明顯,數據更好。懸浮細胞每孔的細胞數可達到105,貼壁細胞可為103-104。
其它的聲音
1. 首先細胞的接種密度一定不能過大,一般每孔1000個左右就夠了,我認為寧少勿多。尤其是對於腫瘤細胞。10000/孔是太高了,這樣即使藥物有作用,MTT方法也是表現不出的,最佳點板濃度在4000-5000/孔,太少的話SD值會很大。(對於不同的細胞,每孔細胞數要摸索一下,對照組OD在1.4以下為佳,當然通常來說更不要超過2。)
2. MTT本身就是比較粗的實驗,增殖率10%左右的波動都不算奇怪。特別是新手,20%的波動也是常見的,所以很可能是技術原因引起的,特別是種板技術一定要過關。
3. 我做的是腫瘤細胞的MTT實驗,這種細胞長的很快一開始我是用100000/ML的濃度來接種的,結果細胞長的太滿結果是沒有梯度也沒有線性關係。後來調整濃度,用過40000~80000/ML的濃度都做過MTT實驗,結果發現做的結果比較好點的是60000~70000/ML的濃度組的。用40000/M的濃度的組,由於細胞少,藥物作用的梯度還是有,只是沒有很好的線性關係。還有根據細胞生長速度以及藥物的特性(有時間依賴性和濃度依賴性的藥物)來確定培養時間是48小時還是72小時。
注意細胞懸液一定要混勻,以避免細胞沉澱下來,導致每孔中的細胞數量不等,可以每接幾個就要再混勻一下。加樣器操作要熟練,儘量避免人為誤差。雖然移液器比移液管精確得多,但是如果操作不熟,CV會在8%左右。另外,吹散次數過多也會影響
細胞活力。所以要熟練些、快些上板。
 mtt
mtt
 mtt
mtt