2013年2月22日美國食品藥品監督管理局(FDA)批准Kadcyla(ado-曲妥珠單抗emtansine),為有HER2-陽性,晚期(轉移)乳癌患者一種新治療。
商品名:Kadcyla
通用名:ado-trastuzumabemtansine
中文名:未知
藥企:Genentech
適應症:用於治療HER-2陽性晚期轉移性乳腺癌
劑型規格:本品為凍乾粉,100mg/瓶或160mg/瓶,推薦劑量3.6mg/Kg/3周(詳見藥品說明書)。
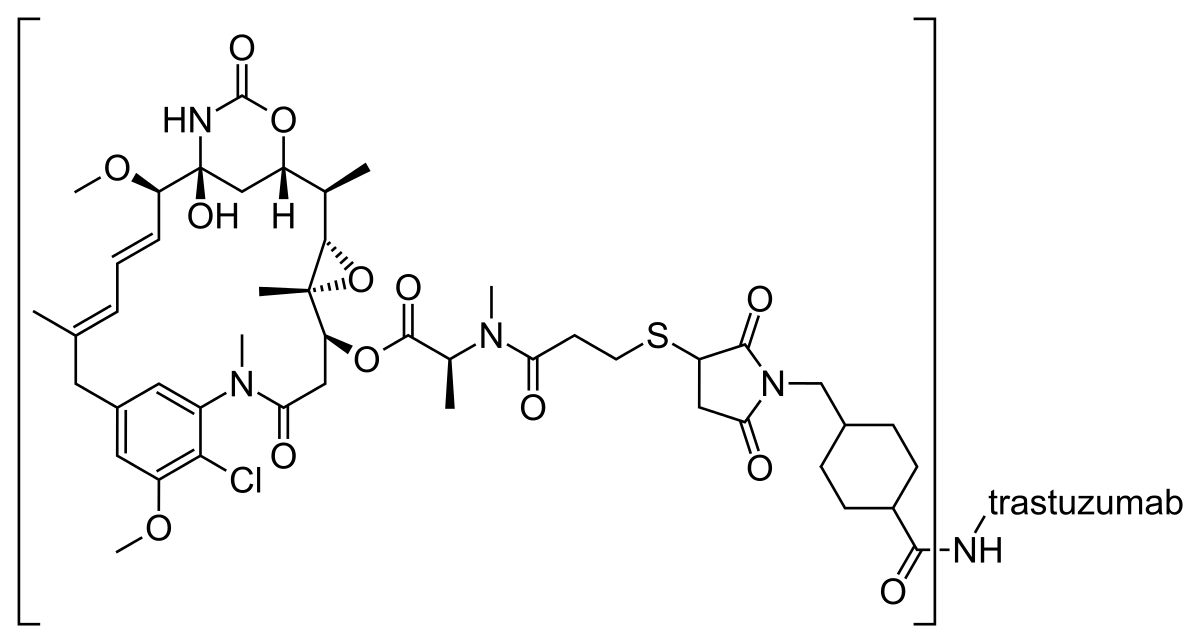
活性成分:ado-trastuzumabemtansine。本品為曲妥珠單抗-Emtansine偶聯物,曲妥珠單抗(抗HER-2IgG1)與DM1(一種美坦辛衍生物,微管抑制劑)通過一硫醚連線子(MCC)連線,emtansine代表DM1-MCC。本品為白色至灰白色無菌凍乾粉。
作用機理:ado-trastuzumabemtansine是一種新型抗體藥物,由曲妥珠單抗和小分子微管抑制劑DM1偶聯而成,產生協同抗癌作用。在原發性乳腺癌患者中觀察到有25%-30%的患者HER2過度表達,曲妥珠單抗是一種重組DNA衍生的人源化單克隆抗體,選擇性地作用於HER-2的胞外部位。DM1是一種美坦辛(某些文獻譯為美登素,maytansine)衍生物,發現與20世紀70年代初期,通過與長春花位點結合,抑制微管蛋白聚集,這是美坦辛首次批准用於臨床。
黑框警告:肝毒性(肝衰竭和壞死,用藥前需監測血清轉氨酶和膽紅素,據此調整劑量或停藥)、心臟毒性(左心室射血分數下降)、胚胎-胎兒毒性(胎兒死亡或先天缺陷)。
不良反應:肺毒性(間質性肺病,包括局部急性肺炎、急性呼吸窘迫綜合徵)、輸液相關性反應、過敏反應、血小板減少、神經毒性、溢出(注射部位紅腫、疼痛等)。
補充說明:FDA批准的用於HER-2陽性乳腺癌的藥物還有曲妥珠單抗(1998年)、拉帕替尼(2007年)、帕妥珠單抗(2012年),除拉帕替尼屬於GlaxoSmithKline外,另外三個產品都均在Genentech旗下。
FDA的藥物評價和研究中心血液學和腫瘤室主任RichardPazdur,M.D.說:“Kadcyla是曲妥珠單抗與一個干擾癌細胞生長被稱為DM1藥連線,”“Kadcyla輸送藥物至癌部位縮小腫瘤,減慢疾病進展和延長生存。是第四個靶向HER2蛋白被批准藥物。”
臨床研究期間被稱為T-DM1,Kadcyla被FDA優先審評,即不存在滿意的另外治療時,對可能安全和有效治療藥物,或與上市產品比較提供重要改善提供6個月加快審評。
在一項991例患者臨床研究中評價Kadcyla的安全性和有效性,患者隨機賦予接受Kadcyla或拉帕替尼加卡培他濱[capecitabine],另一種化療藥。患者接受治療直至或癌進展或副作用不能耐受。研究設計測定無進展生存,患者無癌症進展生存時間長度,和總生存,患者死亡前生存的時間長度。
結果顯示用Kadcyla治療患者中位無進展生存時間9.6個月與之比較用拉帕替尼加卡培他濱治療患者6.4個月。Kadcyla組中位總生存為30.9個月和拉帕替尼加卡培他濱組25.1個月。
通用名:ado-trastuzumabemtansine
中文名:未知
藥企:Genentech
適應症:用於治療HER-2陽性晚期轉移性乳腺癌
劑型規格:本品為凍乾粉,100mg/瓶或160mg/瓶,推薦劑量3.6mg/Kg/3周(詳見藥品說明書)。
活性成分:ado-trastuzumabemtansine。本品為曲妥珠單抗-Emtansine偶聯物,曲妥珠單抗(抗HER-2IgG1)與DM1(一種美坦辛衍生物,微管抑制劑)通過一硫醚連線子(MCC)連線,emtansine代表DM1-MCC。本品為白色至灰白色無菌凍乾粉。
作用機理:ado-trastuzumabemtansine是一種新型抗體藥物,由曲妥珠單抗和小分子微管抑制劑DM1偶聯而成,產生協同抗癌作用。在原發性乳腺癌患者中觀察到有25%-30%的患者HER2過度表達,曲妥珠單抗是一種重組DNA衍生的人源化單克隆抗體,選擇性地作用於HER-2的胞外部位。DM1是一種美坦辛(某些文獻譯為美登素,maytansine)衍生物,發現與20世紀70年代初期,通過與長春花位點結合,抑制微管蛋白聚集,這是美坦辛首次批准用於臨床。
黑框警告:肝毒性(肝衰竭和壞死,用藥前需監測血清轉氨酶和膽紅素,據此調整劑量或停藥)、心臟毒性(左心室射血分數下降)、胚胎-胎兒毒性(胎兒死亡或先天缺陷)。
不良反應:肺毒性(間質性肺病,包括局部急性肺炎、急性呼吸窘迫綜合徵)、輸液相關性反應、過敏反應、血小板減少、神經毒性、溢出(注射部位紅腫、疼痛等)。
補充說明:FDA批准的用於HER-2陽性乳腺癌的藥物還有曲妥珠單抗(1998年)、拉帕替尼(2007年)、帕妥珠單抗(2012年),除拉帕替尼屬於GlaxoSmithKline外,另外三個產品都均在Genentech旗下。
FDA的藥物評價和研究中心血液學和腫瘤室主任RichardPazdur,M.D.說:“Kadcyla是曲妥珠單抗與一個干擾癌細胞生長被稱為DM1藥連線,”“Kadcyla輸送藥物至癌部位縮小腫瘤,減慢疾病進展和延長生存。是第四個靶向HER2蛋白被批准藥物。”
臨床研究期間被稱為T-DM1,Kadcyla被FDA優先審評,即不存在滿意的另外治療時,對可能安全和有效治療藥物,或與上市產品比較提供重要改善提供6個月加快審評。
在一項991例患者臨床研究中評價Kadcyla的安全性和有效性,患者隨機賦予接受Kadcyla或拉帕替尼加卡培他濱[capecitabine],另一種化療藥。患者接受治療直至或癌進展或副作用不能耐受。研究設計測定無進展生存,患者無癌症進展生存時間長度,和總生存,患者死亡前生存的時間長度。
結果顯示用Kadcyla治療患者中位無進展生存時間9.6個月與之比較用拉帕替尼加卡培他濱治療患者6.4個月。Kadcyla組中位總生存為30.9個月和拉帕替尼加卡培他濱組25.1個月。