基本介紹
- 中文名:T細胞17
- 外文名:Th17
- 門:細菌門
- 直徑大小:0.5~5μm之間
前言,特徵,分化,調節,正向調節,負向調節,疾病關係,
前言
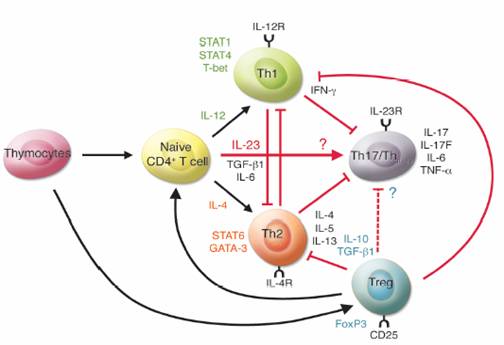
Th17是由TH0細胞在IL6和IL23的刺激下分化而成的輔助性T細胞,主要分泌IL17、IL22等促炎症因子,RORγ是其重要的轉錄因子。TH17細胞在自身免疫中起重要的作用。
TH17輔助細胞主要為對抗細胞外細菌及黴菌的免疫反應,其主要為白介素6(IL-6)及TGFβ所驅動誘發,其主要的執行的細胞因子是白介素1(IL1)白介素6(IL-6)以及TNF-α,其最重要的執行細胞為嗜中性粒細胞(Neutrophil)另外還有產生IgG/IgA/IgM的B細胞以及分泌IL-17的CD4 T細胞等、其主要的轉錄因子為STAT3 另外還有RORγ等等 。CD4 T細胞分泌的IL-17&TNF-α會活化嗜中性粒細胞,使其能夠吞噬並消化掉細胞外細菌及黴菌,另外IL6等也會活化補體反應而直接殺死細胞外細菌及黴菌,TH17免疫反應對應的是第三型自體免疫疾病(Type3 Immune complex & complement hypersensitivity)也就是過分的TH17激活將會導致嗜中性粒細胞自體免疫疾病比如類風濕性關節炎或Arthus反應等都屬此類。
特徵
Th17細胞的主要效應因子是IL-17。近年來發現IL-17 是T 細胞來源細胞因子,該家族包括6 個成員的配體(IL-17A~IL-17F)和5個受體(IL-17RA~IL-17RD和SEF)[3]。IL-17 是一種主要由活化的T 細胞產生的致炎細胞因子,可以促進T 細胞的激活和刺激上皮細胞、內皮細胞、成纖維細胞產生多種細胞因子如IL-6、IL-8、粒細胞- 巨噬細胞刺激因子(GM-CSF)和化學增活素及細胞黏附分子1(cellular adhesion molecule 1,CAM-1),從而導致炎症的產生[4]。IL-17 是T 細胞誘導的炎症反應的早期啟動因子,可以通過促進釋放前炎性細胞因子來放大炎症反應。IL-17 與受體結合後,可通過MAP 激酶途徑和核轉錄因子kB(nuclearfactor kB,NF-kB)途徑發揮其生物學作用[5]。Th17細胞能夠分泌產生IL-17A、IL-17F、IL-6以及a腫瘤壞死因子(tumor necrosis factora, TNF-a)等,這些細胞因子可以集體動員、募集及活化中性粒細胞[6]。Th17細胞產生的IL-17能有效地介導中性粒細胞動員的興奮過程,從而有效地介導了組織的炎症反應。
分化
初始CD4+T 細胞接受抗原刺激後,在不同的條件下可分化成不同亞型的T 細胞,執行不同的功能。其分化方向受抗原的性質、局部環境中的激素及細胞因子等多種因素的調控,其中細胞因子的種類和細胞因子之間的平衡對T h 細胞的分化具有重要的調節作用。初始C D 4 +T 細胞在I L - 1 2 和g 干擾素(interferong, IFN-γ)的誘導下分化為Th1細胞,分泌IFN-γ,參與細胞介導的免疫應答;在IL-4 的誘導下分化為Th2細胞,分泌IL-4、IL-5和IL-13,參與體液免疫應答;在b 轉化生長因子(transforming growthfactorb, TGF-β)單獨誘導下分化為Treg細胞,分泌TGF-β,參與免疫調節;在TGF-β 和IL-6 的共同誘導下分化為Th17,分泌IL-6和IL-17,參與炎症反應和自身免疫性疾病。在此過程中,T 細胞上的相關受體分子及轉錄子都發揮著重要的作用。Th1、Th2 和Treg 的發育和分化分別受轉錄因子T-bet、GATA-3和Foxp3 等的特異性調控[7]。Langrish等[8]研究發現了IL-12家族的新成員IL-23,它與IL-12有著共同的P40亞單位,但是,IL-12二聚體由IL-12P40和IL-12P35組成,而IL-23由IL-12P40和IL-23P19 組成。進一步研究發現,在IL-23缺陷型小鼠中幾乎沒有Th17 細胞產生,IL-23 缺乏不影響Th17 細胞的正常產生,卻使其不能擴展和存活。因此IL-23 不是Th17 分化的必需因子,卻Th17 細胞存活、繁殖的重要因子。在誘導Treg 細胞和Th17 細胞分化的過程中,TGF-β 起著重要的作用。在TGF-β 單獨的作用下,活化的初始CD4+T 細胞分化為Foxp3+Treg 細胞,而在TGF-β 和IL-6 的共同誘導下分化為Th17 細胞,由此說明IL-6抑制了Foxp3+Treg細胞的分化。Veldhoen等[2]將CD25+CD4+T 細胞、初始T 細胞和樹突狀細胞共同培養。在IL-6 存在時,初始T 細胞可以有效分化為Th17 細胞,且具有TGF-β1 依賴性;而在誘導的過程中加入抗IL-6 中和抗體則可促進Foxp3+Treg 細胞的分化。當機體處在穩定狀態下或沒有炎症損傷的情況下,免疫系統產生的TGF-β1 抑制著效應T 細胞的增殖,誘導Treg 細胞表達,從而維持機體的免疫耐受;但當存在感染或炎症時,急性期蛋白IL-6 大量產生,抑制了Treg 細胞表達,與TGF-β1 共同誘導Th17 細胞的分化,從而介導機體的前炎症反應[9]
調節
正向調節
國外學者研究發現[10],在T細胞受體刺激初始CD4+T 細胞激活時,給予IL-23 可以誘導IL-17 產生。IL-23 與其受體結合後可激活JAK-STAT 信號途徑,引起Jak2、Tyk2 磷酸化,促進信號轉導轉錄激活子1(signal transducer and activator of transcription 1,STAT1)、STAT3、STAT4 和STAT5 磷酸化[11]。STAT3 是IL-23重要的信號轉導分子,當STAT3缺陷時,IL-23則失去了誘導IL-17 的作用。IL-23 可以介導STAT3 的磷酸化過程,使STAT3 激活從而促進IL-17 的分泌[12]。近期研究發現[2],CD4+CD25+Treg 細胞能抑制T細胞產生IL-2和IFN-γ,明顯促進IL-17的產生,當加入抗TGF-β 中和性抗體時,可抑制IL-17 的產生。實驗結果表明,TGF-β在誘導初始T 細胞分化成Th17細胞中起著極其重要的作用。在TGF-β 基因敲除的小鼠中CD4+T 細胞產生IL-17 的能力明顯下降,而TGF-β 轉基因小鼠的CD4+T 細胞產生IL-17 的能力明顯增強。IL-6缺陷時也可明顯抑制Th17細胞的分化。最近研究發現[13],孤獨核受體gt (Orphan nuclearreceptor gamma t, RORgt)是控制Th17細胞分化的關鍵的轉錄因子,RORgt 誘導編碼IL-17 和IL-17F 細胞因子基因的表達,TGF-β 和IL-6 可通過誘導大量的RORgt 表達進而啟動RORgt 信號轉導通路,從而促進Th17 細胞的分化。Yang 等[14]還發現,TGF-β 和IL-6可共同誘導RORa 的表達,此過程依賴於STAT3。過高表達的RORa可通過誘導IL-17 和IL-17F 基因中的保守非編碼序列2(conserved noncoding sequence 2,CNS2)來促進Th17 細胞的分化,而RORa 缺陷時則可導致體內外IL-17 明顯減少。RORgt 和RORa 可協同促進Th17 細胞的表達。Bettelli等[15]發現,在IL-6缺陷的條件下,TGF-β和IL-21 共存也可促進CD4+T 細胞分化為Th17 細胞,並釋放IL-21。進一步研究發現,在Th1、Th2細胞中,IL-21 較低水平表達,而在Th17 細胞中IL-21 則高水平表達。炎症反應時體內IL-21 增多,可通過正反饋迴路來進一步促進Th17 細胞的分化,在此過程中則需要RORgt 的表達和IL-23 受體的增量調節。另外,IL-1β 和TNF-α也可以促進TGF-β 和IL-6對Th17 細胞分化的誘導,但是卻不能取代其中的任何一種細胞因子[16]。
負向調節
Park等[9]發現,在誘導過程中加入IFN-γ 的特異性抗體阻斷IFN-γ 的作用後,CD4+T 細胞可以在IL-23的誘導下分化產生高水平的Th17。加入IL-4 的特異性抗體阻斷IL-4 的作用後,也可產生高水平的Th17 細胞亞群。而將IFN-γ 和IL-4 同時用其相應的特異性抗體阻斷後,Th17 亞群細胞的分化則明顯增加。已有研究發現[17],IFN-γ 可以通過抑制TGF-β下游信號轉導因子Smad3 磷酸化,從而阻斷Smad3 對TGF-β 受體的作用,進而干擾TGF-β 誘導Th17 細胞分化的過程。Chen 等[12]發現,細胞因子信號蛋白抑制分子3(Suppressor of cytokine signaling proteins, Socs3)是細胞因子依賴性的STAT3 磷酸化的重要調控因子,即使在TGF-β、IL-6和IL-23同時存在的情況下,Socs3也可以抑制Th17 細胞的分化,Socs3 缺乏時,則可誘導更多的Th17 細胞,並伴隨STAT3 高磷酸化。Socs3對IL-23 介導的STAT3 磷酸化起著負調節作用,進而抑制Th17 細胞的產生與分化。最近研究發現[18],IL-2 是Th17 細胞分化的抑制因素,IL-2缺陷小鼠IL-17的表達增強,加入IL-2則使RORgt 的表達及Th17 的分化受到抑制。進一步研究發現,IL-2 抑制Th17 分化的機制需要STAT5 參與,IL-2 優先活化STAT5,與STAT3 活化RORgt,促進Th17 分化的功能相反,STAT5 可能通過抑制RORgt的活性來抑制Th17 細胞的分化。