簡介
PD-1(程式性死亡受體1),是一種重要的
免疫抑制分子,為免疫球蛋白超家族,是一個268胺基酸殘基的膜蛋白。其最初是從凋亡的小鼠T細胞雜交瘤2B4.11克隆出來。以PD-1為靶點的免疫調節對抗腫瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意義。其配體PD-L1也可作為靶點,相應的抗體也可以起到相同的作用。PD-1和PD-L1結合啟動T細胞的程式性死亡,使腫瘤細胞獲得免疫逃逸。
PD-1至少有兩個配體,一個是PD-L1,一個是PD-L2;PD-L1至少有兩個
配體,一個是PD-1,一個是CD80;PD-L2至少有兩個配體,一個PD-1,一個是RGMB。
PD-1是免疫檢查點,通過兩種機制防止自身免疫。首先,它促進淋巴結中抗原特異性T細胞的凋亡(程式性細胞死亡)。其次,它減少了調節性T細胞(抗炎,抑制性T細胞)的細胞凋亡。
PD-1抑制劑是阻斷PD-1的一類新藥,可激活免疫系統以攻擊腫瘤,並用於治療某些類型的癌症。
人類中的PD-1蛋白由PDCD1基因編碼。PD-1是一種細胞表面受體,屬於免疫球蛋白超家族,在T細胞和pro-B細胞上表達。PD-1結合兩個配體,PD-L1和PD-L2。
發現歷史
在參與細胞凋亡的基因篩選中,Yasumasa Ishida,Tasuku Honjo及其同事於1992年在京都大學發現並命名為PD-1。1999年,同一組證明PD-1被敲除的小鼠易患自身免疫性疾病,因此認為PD-1是免疫應答的負調節因子。
結構
PD-1是268個胺基酸的I型膜蛋白。PD-1是擴增的CD28/CTLA-4家族T細胞調節劑的成員。蛋白質的結構包括細胞外IgV結構域,其後是跨膜區和細胞內尾。細胞內尾部含有位於基於免疫受體酪氨酸的抑制基序和基於免疫受體酪氨酸的開關基序中的兩個磷酸化位點,這表明PD-1負調節T細胞受體TCR信號。這與配體結合後SHP-1和SHP-2磷酸酶與PD-1的細胞質尾部的結合一致。此外,PD-1連線上調E3-遍在蛋白連線酶CBL-b和c-CBL,其觸發T細胞受體下調。PD-1在活化的T細胞,B細胞和巨噬細胞的表面上表達,表明與CTLA-4相比,PD-1更廣泛地負調節免疫應答。
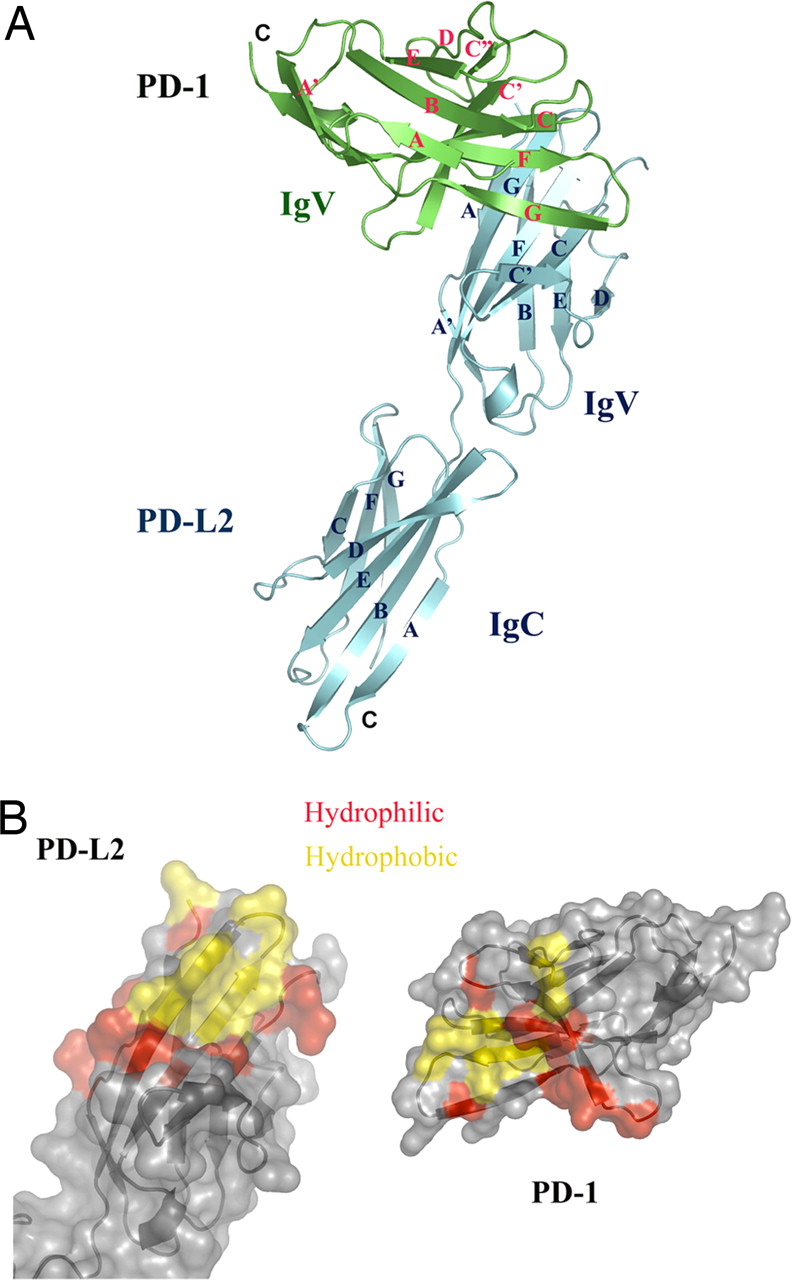 PD-1
PD-1功能
幾個證據表明PD-1及其配體負調節免疫反應。已經顯示PD-1敲除小鼠分別在C57BL / 6和BALB / c背景上發展出狼瘡樣腎小球腎炎和擴張性心肌病。在體外,用PD-L1-Ig處理抗CD3刺激的T細胞導致T細胞增殖和IFN-γ分泌減少。IFN-γ是一種促進T細胞炎症活性的關鍵促炎細胞因子。減少的T細胞增殖也與減弱的IL-2分泌相關,並且這些數據一起表明PD-1負調節T細胞應答。
使用PD-L1轉染的DC和表達PD-1的轉基因(Tg)CD4和CD8T細胞的實驗表明CD8T細胞更易受PD-L1的抑制,儘管這可能取決於TCR信號傳導的強度。 。與負調節CD8T細胞反應的作用一致,使用慢性感染的LCMV病毒載體模型,Rafi Ahmed的研究表明,PD-1-PD-L1相互作用抑制病毒特異性CD8的效應功能的激活,擴增和獲得T細胞,可以通過阻斷PD-1-PD-L1相互作用來逆轉。
PD-L1在腫瘤細胞上的表達通過PD-1與效應T細胞的結合來抑制抗腫瘤活性。PD-L1在腫瘤中的表達與食管癌,胰腺癌和其他類型癌症的存活率降低相關,突出了該途徑作為免疫治療的靶標。觸發PD-1,在單核細胞上表達並在單核細胞活化時上調,其配體PD-L1誘導IL-10產生,其抑制CD4 T細胞功能。
在小鼠中,當注射抗CD3抗體並且大量胸腺細胞經歷凋亡時,在胸腺中誘導該基因的表達。在BALB / c背景上培育的該基因缺陷的小鼠出現擴張性心肌病並死於充血性心力衰竭。這些研究表明,該基因產物在T細胞功能中也可能是重要的,並有助於預防自身免疫疾病。
PD1在CD8 + T細胞上的過表達是T細胞耗竭的指標之一(例如在慢性感染或癌症中)。
臨床意義
癌症
PD1的配體PD-L1在幾種癌症中高度表達,因此PD1在癌症免疫逃避中的作用已得到很好的證實。正在開發用於增強免疫系統的靶向PD-1的單克隆抗體用於治療癌症。許多腫瘤細胞表達PD-L1,一種免疫抑制PD-1配體;抑制PD-1和PD-L1之間的相互作用可以增強體外T細胞反應並介導臨床前抗腫瘤活性。這被稱為免疫檢查點封鎖。
使用抗PD1和抗CTLA4治療劑的聯合治療已成為檢查點抑制領域內的重要腫瘤治療。
已顯示PD1和CTLA4抗體的組合在治療多種癌症中比單獨的任一種抗體更有效。兩種抗體的作用似乎並不多餘。抗-CTLA4治療導致增強的抗原特異性T細胞依賴性免疫反應,而抗-PD-1似乎重新激活CD8 + T細胞裂解癌細胞的能力。
在臨床試驗中,儘管由於抗-CTLA4治療引起的毒性水平增加,聯合治療已被證明可有效減少對單一共抑制性阻斷無反應的患者的腫瘤大小。誘導高達十倍的更高數目的CD8 + T細胞正在積極浸潤腫瘤組織的PD1和CTLA4的組合。作者假設較高水平的CD8 + T細胞浸潤是由於抗-CTLA-4抑制CD4 T細胞向T調節細胞的轉化,並進一步降低了抗-PD-1的T調節抑制。這種組合促進了對腫瘤的更強的炎症反應,從而減小了癌症的大小。最近,FDA批准了一種抗CTLA4聯合治療(ipilimumab)和抗PD1(nivolumab)於2015年10月。
使腫瘤接受抗PD1治療所必需的分子因子和受體仍然未知。癌細胞表面上的PDL1表達起重要作用。PDL1陽性腫瘤對組合治療的反應可能性是其兩倍。然而,PDL1陰性腫瘤患者對抗PD1的反應也有限,這表明PDL1表達不是治療有效性的絕對決定因素。
腫瘤中較高的突變負荷與抗PD-1治療的較大效果相關。在臨床試驗中,受益於抗PD1治療的患者患有癌症,例如黑素瘤,膀胱癌和胃癌,其平均突變數中位數高於對治療無反應的患者。然而,較高的腫瘤負荷與PD-1免疫阻斷的臨床有效性之間的相關性仍然不確定。
2018年諾貝爾醫學獎授予James P Allison和Tasuku Honjo,“因為他們通過抑制負免疫調節來發現癌症治療”。
抗PD-1療法
主要文章:PD-1和PD-L1抑制劑
已經開發了許多靶向PD-1受體的癌症免疫治療劑。
一種這樣的抗PD-1抗體藥物nivolumab(Opdivo-Bristol-Myers Squibb)在一項臨床試驗中對非小細胞肺癌,黑色素瘤和腎細胞癌產生完全或部分反應296名患者。結腸癌和胰腺癌沒有反應。Nivolumab(Opdivo,Bristol-Myers Squibb)於2014年7月在日本獲得批准,2014年12月由美國FDA批准用於治療轉移性黑色素瘤。
Pembrolizumab(Keytruda,MK-3475,Merck)也是針對PD-1受體的,於2014年9月被FDA批准用於治療轉移性黑素瘤。Pembrolizumab已於2015年3月通過英國早期藥物計畫(EAMS)向英國的晚期黑色素瘤患者開放。它正在美國用於肺癌,淋巴瘤和間皮瘤的臨床試驗。它已經取得了成功,副作用很小。藥物製造商應向FDA提交申請,以便批准用於這些疾病。2015年10月2日,Pembrolizumab被FDA批准用於其他治療後疾病進展的晚期(轉移性)非小細胞肺癌(NSCLC)患者。
靶向PD-1受體(檢查點抑制劑)的早期發育中的其他藥物是Pidilizumab(CT-011,Cure Tech)和BMS-936559(Bristol Myers Squibb)。既Atezolizumab(MPDL3280A,Roche)和Avelumab(默克公司,德國達姆施塔特&輝瑞)靶向類似PD-L1受體。
動物研究
愛滋病毒
靶向PD-1的藥物與其他負免疫檢查點受體(例如(TIGIT))組合可以增強免疫應答和/或促進HIV根除。在慢性HIV感染的情況下,T淋巴細胞表現出升高的PD-1表達。PD-1受體的存在增加對應於HIV特異性CD8 +細胞毒性和CD4 +輔助性T細胞群的耗盡,這些細胞群對抗病毒至關重要。PD-1的免疫阻斷導致對抗疾病進展所必需的T細胞炎症表型的恢復。
阿爾茨海默病
阻斷PD-1導致腦澱粉樣蛋白β斑塊減少並改善小鼠的認知表現。PD-1的免疫阻斷引起IFN-γ依賴性免疫應答,其將單核細胞衍生的巨噬細胞募集到腦中,然後能夠從組織中清除澱粉樣蛋白-β斑塊。發現重複給予抗-PD-1是維持治療效果所必需的。澱粉樣纖維是免疫抑制劑,這一發現已通過檢查原纖維在神經炎症疾病中的作用而單獨證實。PD-1通過增強免疫活性和觸發允許大腦修復的免疫途徑來抵消原纖維的作用。
 PD-1
PD-1
 PD-1
PD-1