EYLEA適用於治療有新生血管(濕)年齡相關黃斑變性(AMD)患者。
基本介紹
- 中文名:Eylea
- 外文名:Aflibercept
- 生產商:拜耳
- 適應症:黃斑變性(AMD)患者
劑量給藥方法,劑型和規格,禁忌證,注意事項,不良反應,特殊人群使用,一般描述,臨床藥理學,非臨床毒理學,臨床研究,供應貯存處置,患者諮詢資料,
劑量給藥方法
2.1 一般給藥信息
只為眼科玻璃體內注射。必須只由合格醫生給予EYLEA。
 Eylea(aflibercept/阿普西柏)
Eylea(aflibercept/阿普西柏)2.2 給藥
EYLEA 推薦劑量對頭12周(3個月)是2 mg(0.05 mL或50 μl)玻璃體內注射給予每4周1次(每月),接著通過玻璃體內注射2 mg(0.05 mL)每8周1次(2個月)。儘管EYLEA可給藥頻繁如2 mg每4周1次(每月),當EYLEA每4周與每8周給藥比較[見臨床研究未證實增加療效(14)]。
2.3 為給藥配製
給藥前應視力觀測EYLEA。如可見到顆粒,雲霧狀,或變色必須不使用該小瓶。
用無菌術,玻璃體內注射套用30-號× ½-寸注射針進行。
小瓶
玻璃小瓶只為單次使用。
2.4 給藥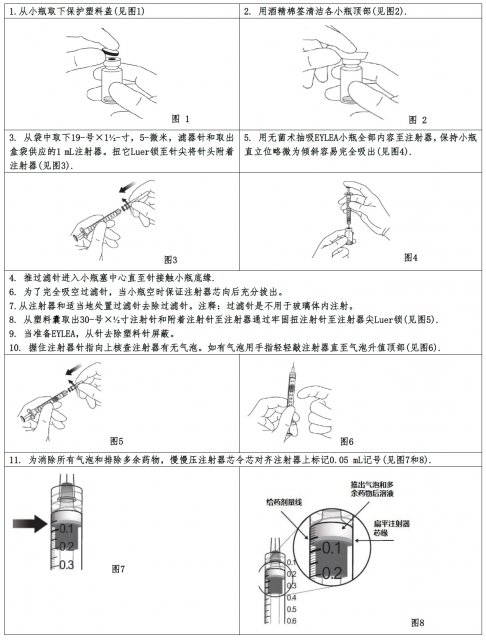 Eylea(aflibercept/阿普西柏)小瓶
Eylea(aflibercept/阿普西柏)小瓶
 Eylea(aflibercept/阿普西柏)小瓶
Eylea(aflibercept/阿普西柏)小瓶應在控制無菌條件下進行玻璃體內注射步驟,包括外科手消毒和使用無菌手套,無菌披戴,和無菌眼瞼窺器(或等同物)。適當麻醉和注射前應給予局部用廣譜殺微生物劑。
玻璃體內注射後立即,應監視患者眼內壓的升高。適當監視可能由核查視神經頭灌注或眼內壓組成。如需要,應得到無菌穿刺針。
玻璃體內注射後,應指導患者無延緩地報告任何眼內炎或視網膜脫落提示性症狀(如,眼疼痛,眼發紅,畏光,視力模糊)[見患者諮詢信息(17)]。
每個小瓶只應為治療單眼使用。如對側眼需要治療,應使用一個新小瓶和消毒野,注射器,手套,消毒單, 眼瞼窺器,濾器,和注射針給予另一隻眼EYLEA前變換。
注射後,應遺棄任何未使用產品。
對於任何曾研究人群不需要調整劑量(如,性別,老年人)。
劑型和規格
單次使用,玻璃小瓶設計成提供40 mg/mL的0.05 mL為玻璃體內注射溶液。.
禁忌證
4.1 眼或眼周感染
眼或眼周感染患者中禁忌EYLEA。
4.2 活動性眼內炎症
有活動性眼內炎症患者禁忌EYLEA。
4.3 超敏性
已知對aflibercept或EYLEA中任何賦形劑超敏性患者禁忌EYLEA。
注意事項
5.1 眼內炎和視網膜脫落
玻璃體內注射,包括那些用EYLEA,增伴隨眼內炎和視網膜脫落[見不良反應(6.1)]。當給予EYLEA必須經常使用適當無菌注射技術。應指導患者不延遲地報告任何眼內炎或視網膜脫落提示性症狀和應被適當處理。[見劑量和給藥方法(2.4)和患者諮詢信息(17)]。
5.2 眼內壓增加
玻璃體內注射,包括用EYLEA曾見到60分鐘內眼內壓急性增加[見不良反應(6.1)]。用VEGF抑制劑重複玻璃體內給藥後也曾報導眼內壓持續增加。應監視眼內壓和視神經頭灌注和適當處理[見劑量和給藥方法(2.4)]。
5.3 血栓栓塞事件
玻 璃體內使用VEGF抑制劑,包括EYLEA後有動脈血栓栓塞事件(ATEs)潛在風險。ATEs被定義為非致命性中風,非致命性心肌梗死,或血管死亡(包 括未知原因的死亡)。濕AMD研究VIEW1和VIEW2中用EYLEA治療患者的聯用組中頭一年期間發生率為1.8%(32/1824)[見臨床研究 (14)]。
不良反應
在說明書其它節中詳細討論下列不良反應:
(1)眼內炎和視網膜脫落[見警告和注意事項(5.1)]
(2)眼內壓增加[見警告和注意事項(5.2)]
(3)血栓栓塞事件[見警告和注意事項(5.3)]
接受EYLEA患者中報導的最常見不良反應(≥5%)是結膜出血,眼疼痛,白內障,玻璃體脫落,玻璃體飛蚊症,和眼內壓增加。
6.1注射步驟
用EYLEA玻璃體內注射曾發生與注射步驟相關嚴重不良反應<0.1%包括眼內炎,創傷性白內障,和眼內壓增加。
6.2 臨床研究經驗
因為臨床試驗是在廣泛不同條件下進行,某藥臨床試驗觀察到的不良反應率不能與另一藥物臨床試驗中的發生率直接比較而且可能不反映實踐中觀察到的發生率。
下面描述資料反映在1824例濕性AMD患者,包括用2-mg劑量治療,在2項雙模擬,陽性對照臨床研究(VIEW1和VIEW2)共12個月1223例患者對EYLEA的暴露[見臨床研究(14)].
6.3 免疫原性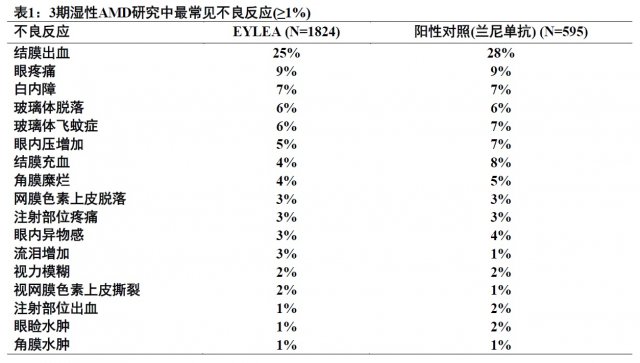 Eylea不良反應說明
Eylea不良反應說明
 Eylea不良反應說明
Eylea不良反應說明如 同所有治療性蛋白,用EYLEA治療患者有免疫反應的潛能。在血清樣品中評價EYLEA免疫原性。免疫原性資料反映檢驗結果被認為是在免疫分析中對 EYLEA抗體陽性患者的百分率。The detection of an 免疫反應的潛能的檢測是高度依賴於所用分析方法的靈敏度和特異性,樣品採集,樣品採集時間,同時用藥,和所患疾病。因為這些理由,比較對EYLEA抗體發 生率與對其它產品抗體發生率可能是誤導。
在3期研究中,對EYLEA治療前免疫反應性發生率跨越治療組是1%至3%。EYLEA給藥後52周,被檢測到對EYLEA抗體患者百分率範圍相似。有或無免疫反應性患者間療效和安全性無差別。
特殊人群使用
8.1 妊娠
妊娠類別C。在妊娠兔中在器官形成期給予靜脈劑量3至60 mg/kg時,Aflibercept產生胚胎胎兒毒性。在胎畜中觀察到一系列外部,內臟,骨骼畸形。母體無觀察到不良效應水平(NOAEL)是3 mg/kg,而胎畜NOAEL低於3 mg/kg。在這個劑量,基於游離aflibercept Cmax和AUC的全身暴露,當與在人中玻璃體內劑量2 mg觀察到相應數值比較時分別較高約2900倍和600倍。
在妊娠婦女中無適當和對照良好研究。妊娠期間只有如潛在獲益超過對胎兒潛在風險時才應使用EYLEA。
8.3 哺乳母親
不知道aflibercept是否排泄至人乳汁。因為許多藥物排泄至人乳汁,不能排除對哺乳兒童的風險。不建議在哺乳期間用EYLEA。必須做出決策是否終止哺乳或終止用EYLEA治療,考慮藥物對母親的重要性。
8.4 兒童使用
尚未確定Eylea在兒童患者中的安全性和有效性。
8.5 老年人使用
在臨床研究中,約89%(1616/1817例)隨機化用EYLEA治療患者是≥65歲和約63%(1139/1817例)是≥75歲。在這些研究中隨年齡增加療效或安全性無明顯差別。
一般描述
EYLEA(aflibercept) 是一種重組融合蛋白人VEGF受體1和2細胞外結構區部分融合至人IgG1的Fc部分組成製劑為等滲溶液為玻璃體內給藥。Aflibercept是一個二 聚體糖蛋白有蛋白分子量97千道爾頓(kDa)和含糖基化,構成總分子量的另外15%,導致總分子量115 kDa。Aflibercept是在重組中國倉鼠卵巢(CHO)細胞中生產。
EYLEA是已知無菌,澄明,和無色至淡黃色溶液。以無防腐劑,無菌水溶液在一個單次使用,玻璃小瓶被設計輸送0.05 mL(50 μL)EYLEA(40 mg/mL在10 mM磷酸鈉,40 mM氯化鈉,0.03%聚山梨醇20,和5%蔗糖,pH 6.2)供應。
臨床藥理學
12.1 作用機制
血 管內皮生長因子-A(VEGF-A)和胎盤生長因子(PlGF)是血管生成因子VEGF家族的成員that可作用如同t as 對內皮細胞有絲分裂, 趨化性,和血管通透性因子。VEGF作用通過兩個受體酪氨酸激酶,VEGFR-1和VEGFR-2,存在與內皮細胞表面。PlGF只與VEGFR-1結 合,也在白細胞表面存在。通過VEGF-A對這些受體的激活可能導致新生血管形成和血管通透性。
Aflibercept作用如同可溶性誘餌受體[decoy receptor]與VEGF-A和PlGF結合,和因此可抑制這些同源[cognate]VEGF受體結合和激活。.
12.2 藥效動力學
在3期研究中,在所有治療組中疾病活動度的解剖測量從基線至52周的改善相似。解剖數據未被使用影響治療決策。
12.3 藥代動力學
EYLEA 被玻璃體內給予在眼內發揮局部效應。在濕性AMD患者中,玻璃體內給予EYLEA後,預期給予劑量的一個分數結合至眼中與內源性VEGF形成無活性 aflibercept:VEGF複合物。一旦吸收至全身循環,以游離aflibercept存在血漿中(未結合至VEGF)和更主要穩定無活性形式與循 環內源性VEGF(即,aflibercept: VEGF複合物)。
吸收/分布
玻璃體內給予2 mg EYLEA每眼至濕性AMD患者後,血漿中游離aflibercept平均Cmax為0.02 μg/mL(範圍:0至0.054 μg/mL)和達到1至3天。在所有患者中給藥後2週遊離aflibercept血漿濃度是不可檢測的。當每4周玻璃體內重複給藥時 Aflibercept在血漿中不積蓄。估計玻璃體內給予2 mg至患者後,血漿游離aflibercept平均最大濃度是低於-最大結合全身VEGF半數所需aflibercept濃度大於100倍。
曾測定靜脈(I.V.)給予aflibercept後游離aflibercept分布容積約為6L.
代謝/消除
Aflibercept 是一種治療性蛋白和未曾進行藥物代謝研究。Aflibercept預期通過目標介導處置通過與游離內源性VEGF結合和通過蛋白水解二方面代謝。靜脈給予 劑量2至4 mg/kg aflibercept血漿中游離aflibercept末端消除半衰期(t1/2)是約5至6天。
特殊人群
腎受損
在一項3期研究子組患者(n=492)的藥代動力學分析,其中43%患者有腎受損(輕度n=120,中度n=74,和嚴重n=16),揭示關於玻璃體內給藥每4或8周后游離aflibercept血漿濃度無差別。無需根據腎受損狀態調整劑量。
非臨床毒理學
13.1 癌發生, 突變發生, 生育能力受損
對 aflibercept的致突變性或致癌性潛能未進行研究。一項猴中6-個月研究靜脈給予aflibercept在劑量範圍從3至30 mg/kg,其一部分評估對雄性和雌性生育能力效應。在所有劑量水平觀察到在雌性無或不規則月經伴有雌性生殖激素水平變化和精子形態學和運動力變化。此 外,雌性顯示卵巢和子宮重量減低伴隨黃體發育受損和成熟濾泡減少。這些變化與子宮和陰道萎縮相關。不能確定無觀察到不良效應水平(NOAEL)。根據在最 低所用劑量3 mg/kg觀察到游離aflibercept的Cmax和AUC,全身暴露分別約是在人中玻璃體內給藥2 mg後觀察到暴露較高4900倍和1500倍。所有變化都是可逆的。
13.2 動物毒理學和/或藥理學
在猴中用玻璃體內劑量2或 4 mg aflibercept/眼處理觀察到鼻甲骨呼吸上皮糜爛和潰瘍。在猴中在NOAEL 0.5 mg/眼。根據Cmax和AUC全身暴露分別為在人中玻璃體內給藥2 mg後觀察到暴露較高42倍和56倍。臨床研究中未見相似效應[見臨床研究(14)]。
臨床研究
在濕性AMD患者中的兩 項隨機化,多中心,雙盲,陽性對照研究評估EYLEA的安全性和療效。在兩項研究中(VIEW1和VIEW2)總計2412例患者被治療和可為療效評價的 (1817例用EYLEA)。在各項研究中,患者被隨機地賦予以1:1:1:1比率至4個給藥方案之一:1) EYLEA給予2 mg每8周接著3個初始每月劑量(EYLEA 2Q8);2) EYLEA給予2 mg每4周(EYLEA 2Q4);3) EYLEA 0.5 mg給予每4周(EYLEA 0.5 Q4);和4)蘭尼單抗給予0.5 mg每4周(蘭尼單抗0.5 mg Q4)。患者年齡範圍從49至99歲有均數76歲。
在兩項研究中,主要療效終點是保持視力患者比例,被定義為在52周時與基線比較喪失少於15字母的視力。可得到數據直至第52周。顯示兩個EYLEA 2Q8和EYLEA 2Q4組有療效在臨床上等同於蘭尼單抗0.5 mg Q4 組。
下面表2和圖9顯示VIEW1和VIEW2研究分析的詳細結果。
圖9: VIEW1和VIEW2 研究中視力從基線至第52周平均變化。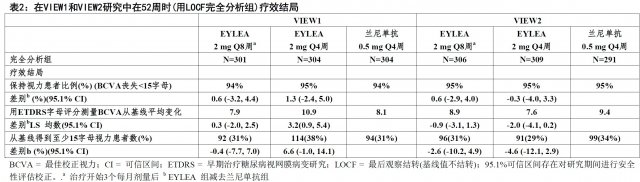 VIEW1和VIEW2研究分析的詳細結果
VIEW1和VIEW2研究分析的詳細結果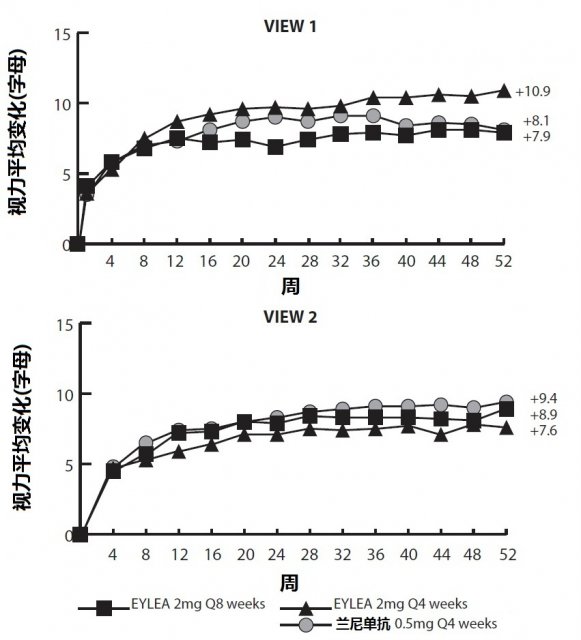 VIEW1和VIEW2研究分析的詳細結果
VIEW1和VIEW2研究分析的詳細結果
 VIEW1和VIEW2研究分析的詳細結果
VIEW1和VIEW2研究分析的詳細結果 VIEW1和VIEW2研究分析的詳細結果
VIEW1和VIEW2研究分析的詳細結果供應貯存處置
每小瓶只是為單眼使用。EYLEA供應如下 [見劑量和給藥方法(2.3)和(2.4)].
NDC 號61755-005-02;紙箱類型小瓶;紙箱內容:一個單次使用,無菌,3-mL,玻璃小瓶含0.278 mL充滿40 mg/mL EYLEA;一個19-號×1½-寸,5-微米,過濾針為抽吸小瓶內容;一個30-號×½寸注射針為玻璃體內注射;一個1-mL注射器給藥;一個包裝外掛程式 說明書。
貯存
EYLEA應貯存在冰櫃在2°C至8°C (36°F至46°F)。不要凍結。不要使用超出標籤上日期的藥物。用前避光保存在原始紙盒內。
患者諮詢資料
用EYLEA玻璃體內注射後患者可能經受短暫視力障礙和伴隨眼檢查[見不良反應(6)]。應建議患者不要駕駛或使用機械直至視力功能已充分恢復。
EYLEA給藥後數天內。患者處於發生眼內炎或視網膜脫落風險。如眼變紅,對光敏感,疼痛,或發生視力變化,患者應立即求眼科醫生醫護[見警告和注意事項(5.1)]。
REGENERON
Manufactured by:
Regeneron Pharmaceuticals, Inc.777 Old Saw Mill River RoadTarrytown, NY 10591-6707
U.S. License Number 1760EYLEATM is the trademark of Regeneron Pharmaceuticals, Inc.?2011 Regeneron Pharmaceuticals, Inc.All rights reserved. V1.0Issue Date: November/2011Initial U.S. Approval: 2011Regeneron U.S. Patents 7,306,799; 7,531,173; 7,608,261; 7,070,959; 7,374,757; 7,374,758,和other pending patents
