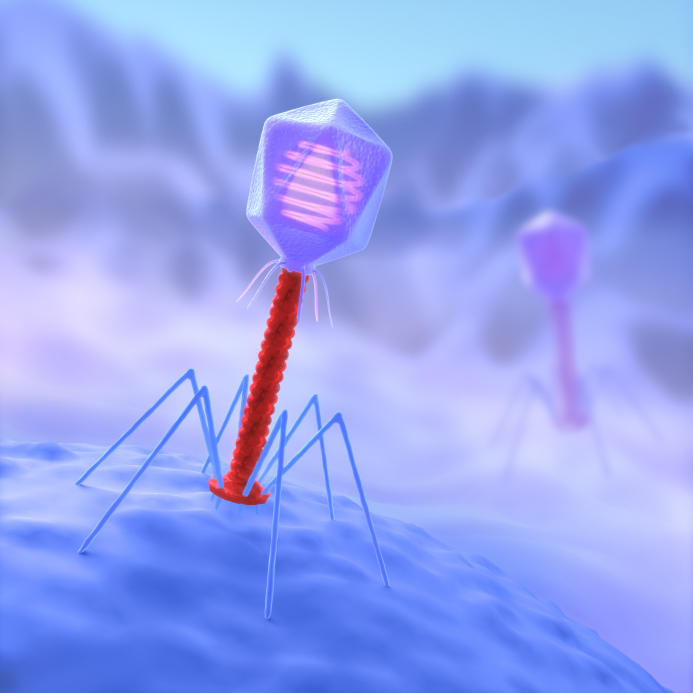
功能特點
CRISPR是生物科學領域的遊戲規則改變者,這種突破性的技術通過一種名叫Cas9的特殊編程的酶發現、切除並取代DNA的特定部分。這種技術的影響極其深遠,從改變老鼠皮毛的顏色到設計不傳播瘧疾的蚊子和抗蟲害作物,再到修正鐮狀細胞性貧血等各類遺傳疾病等等。該技術具有非常精準、廉價、易於使用,並且非常強大的特點。
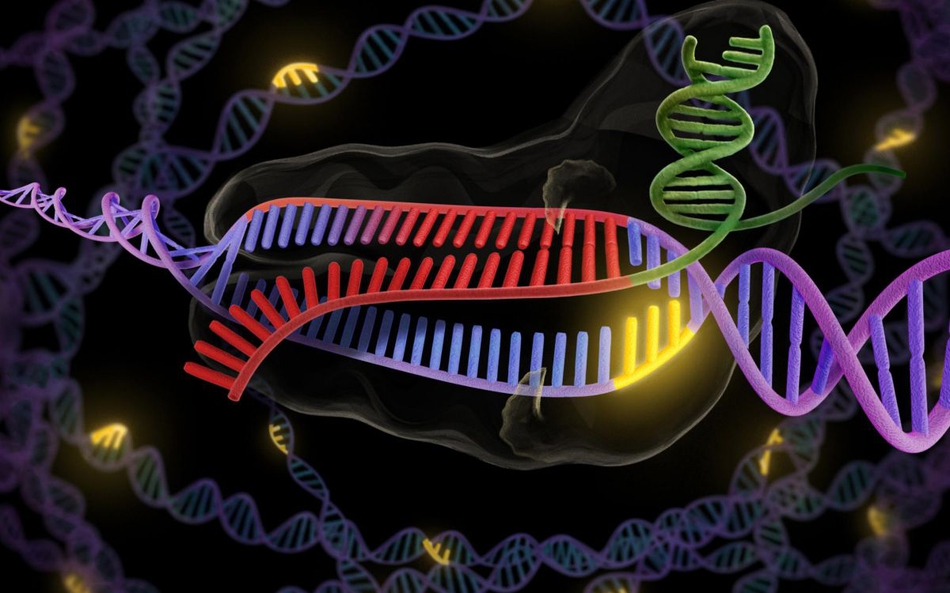
CRISPR來自微生物的免疫系統,這種工程編輯系統利用一種酶,能把一段作為引導工具的小RNA切入DNA,就能在此處切斷或做其他改變。以往研究表明,通過這些介入,CRISPR能使基因組更有效地產生變化或突變,效率比TALEN(轉錄激活因子類感受器核酸酶)等其他基因編輯技術更高。雖然CRISPR有許多優點,在人類癌細胞系列中,它也可能產生大量“誤傷目標”,尤其是對不希望改變的基因做修改。
研究歷史
世界
CRISPR技術是在20世紀90年代初發現的,並在7年後首次用於生物化學實驗,迅速成為人類生物學、農業和微生物學等領域最流行的基因編輯工具。
自2012年以來,研究人員常用一種叫做CRISPR的強大“基因組編輯”技術對生物的DNA序列進行修剪、切斷、替換或添加。美國約翰·霍普金斯大學醫學院的科學家證明,這一系統還能精確有效地改變人類的幹細胞。研究人員指出,這一發現簡化了對誘導多能幹細胞(iPSCs)的修改和定製,有望更快在治療上取得成果,開發出用於疾病研究和藥物測試的模型系統。相關論文線上發表於《分子治療》上。
2015年1月6日,為了研究這種副作用在人類其他細胞中是否也存在,研究小組用CRISPR和TALEN兩種系統在人類的iPSCs中進行實驗,讓它們在iPSCs中切下已知的基因片段,或切掉後再換上其他的。他們用JAK2、SERPINA1和AAVS1基因作為模型,JAK2基因變異會導致骨髓紊亂,真性紅細胞增多症;SERPINA1基因變異會導致alpha1-抗胰蛋白酶缺乏,這是一種遺傳性紊亂,會造成肺和肝臟疾病;而AAVS1最近發現是人類基因組中的“安全港”,可以插入外來基因。
通過比較發現,在這三個基因系統中,如果只是簡單地切掉部分基因,CRISPR系統明顯比TALEN更有效,產生的剪下是後者的100倍;而在做基因替代操作時,如替代JAK2和SERPINA1中的致病變異,CRISPR和TALEN的效率相當。
研究人員還指出,與人類癌細胞系研究不同的是,無論CRISPR還是TALEN,在人類iPSCs中同樣都有著目標特異性,即只瞄準那些為它們設定的目標基因。他們還發現,CRISPR系統比TALEN更有優勢:CRISPR可以設計成只瞄準病人體內含有變異的基因,而不影響健康基因,即只影響某個基因的一個副本。這些成果與以往的幹細胞研究成果結合,使CRISPR成為一種有用的人類iPSCs基因剪輯工具,其偏離目標的風險更小。
約翰·霍普金斯大學醫學院導師葉朝輝(音譯)說,他們的研究詳細說明了如何將CRISPR技術用於人類iPSCs,展現了該技術在這類細胞中的潛力。“幹細胞技術正在迅速發展。我們認為,將iPSCs用於人類治療的日子已經不遠。”
中國
中國一直處在CRISPR研究的最前沿。2014年,南京大學的研究人員宣布成功創造出定向突變的基因工程猴,這是有記錄以來首次在非人類靈長目動物身上成功使用此項技術。
2016年8月,
四川大學華西醫院腫瘤學家
盧鈾率領的一個中國科學家團隊將開展全球首例對人體使用革命性基因編輯技術CRISPR的試驗。
該團隊計畫於2016年8月開始在肺癌患者身上測試經過CRISPR技術編輯的細胞。這些研究人員計畫招募一批轉移性非小細胞肺癌患者,對他們來說,化療和放療等其他選擇都已失敗。他們將從患者血液中提取免疫細胞,利用CRISPR加入一個幫助免疫系統定向清除腫瘤的新基因序列,然後再把這些細胞注入患者的血液。
美國已經批准一個由技術大亨肖恩·帕克支持的研究團隊開展CRISPR人類測試。如果四川大學的研究2016年8月如期啟動,那么它將超越美國成為世界首例CRISPR人類測試。需要指出的是,四川大學開展的試驗不編輯基因種系,其影響不會被遺傳。
2018年7月開始,另一項基因編輯實驗將在中國進行,並將嘗試使用CRISPR技術來破壞人類乳突瘤病毒(HPV)的基因,並有效地摧毀病毒,據悉,人類乳突瘤病毒已被證實可促使宮頸癌腫瘤生長。
技術套用
CRISPR技術可以糾正導致疾病的基因錯誤
肥厚型心肌病(HCM)是一種心臟疾病,影響著全球0.2%的居民,該患者群體將承受巨大的痛苦,而且該疾病會致命。一些顯性基因的突變導致心臟組織變粘稠,這可能導致胸痛、虛弱,嚴重的情況下會心臟驟停。由於近年來醫學技術快速發展,肥厚型心肌病患者的平均預期壽命現已接近普通人群的壽命,但如果不及時進行治療,會引發危及生命的情況。
但未來有一天,我們也許可以通過基因編輯來徹底治癒這種疾病。2017年夏季,美國俄勒岡健康與科學大學的科學家使用CRISPR技術刪除可生育人類胚胎中一個缺陷基因,這項研究為科學家們帶來了希望。他們在胚胎受精後18小時內注入結合CRISPR-Cas9技術機制的54個胚胎,其中36個胚胎並未顯示任何基因突變(實際上沒有形成這種疾病),13個胚胎部分沒有出現基因突變(遺傳肥厚型心肌病的機率為50%)。
在54個胚胎中僅有13個出現非目標基因突變和嵌合體(mosaics),這裡的嵌合體是指一些細胞發生了相應的變化,意味著一小部分人會基因變異。
為了進一步減少這些變化,研究人員進行了另一項實驗,他們在胚胎受精時直接對胚胎中相同的基因進行了校正。結果發現僅有一個嵌合體,這是一個令人印象深刻的實驗結果。使得這項研究比其他同類研究更有效(2015年中國科學家進行的一項臨床試驗中,無法消除嵌合體的可能性)。
該研究報告第一作者、俄勒岡健康與科學大學的研究員舒克拉特?米塔利波夫(Shoukhrat Mitalipov)說:“通過使用這項技術,我們有可能減輕這種遺傳性疾病對家庭造成的負擔,最終影響全人類。”在胚胎髮育早期階段發現這種基因,可以減少或者消除患者生命後期的治療需求。
儘管一些幹細胞科學家置疑是否這幾十個基因突變真實有效,但這項研究幫助科學家更好地理解CRISPR技術的有效性。此外,肥厚型心肌病研究報告合著作者表示,我們有興趣將這項技術套用於降低乳腺癌風險的特定基因突變(BRCA1 和BRCA2)。
CRISPR技術可消除導致疾病的微生物
雖然愛滋病治療是從感染致命殺手病毒轉變為健康狀態,但是科學家仍沒有找到有效的解決辦法。這種狀況可能會隨著CRISPR技術的發展而改變,2017年,中國一支研究小組通過複製一種變異基因,有效地阻止病毒進入細胞,從而增大了老鼠對愛滋病毒的抗性。科學家只在動物身體進行此類實驗,但有理由認為同樣的方法也適用於人類,這種基因突變可以增強人類對愛滋病毒的免疫力。
在一項略有不同的實驗中,美國北卡羅來納州的科學家使用CRISPR技術設計噬菌體,這是一種能在細菌內感染並複製自身的病毒,從而殺死有害細菌。自20世紀20年代以來,噬菌體已被用於臨床實驗,治療細菌感染。但是通過自然途徑採集它們是很困難的,因為當時缺乏對噬菌體的認知,並且無法預測結果,同時,抗生素市場的不斷增長使得噬菌體的套用逐漸不受歡迎。
儘管人體試驗尚未開始,但是研究人員對使用CRISPR技術設計噬菌體保持樂觀態度,因為它們是一種經過驗證的、安全的治療細菌感染方法。事實上,在2017年的一項實驗中,研究人員使用CRISPR技術設計噬菌體拯救感染耐抗生素傳染病的老鼠生命。
CRISPR技術可以復活某些物種
2017年2月,哈佛大學遺傳學家喬治·丘奇(George Church)在美國科學促進協會年會上發表了一項令人驚訝的聲明,他表示自己帶領的研究團隊還有兩年時間就能成功培育出大象-猛獁雜交體胚胎。
丘奇在接受《新科學家》雜誌記者採訪時說:“我希望恢復多毛猛獁能夠阻止全球氣候轉暖,猛獁需要凍土帶生活環境,土地上存在著厚厚積雪和冷空氣。”
目前,丘奇和他的團隊希望利用CRISPR技術將亞洲象(一種潛在被拯救的瀕危物種)和猛獁的基因物質結合在一起,猛獁的基因物質樣本是通過西伯利亞冰凍毛團球中的DNA提取的。通過添加猛獁基因到亞洲象體內,最終該生物體將具有猛獁的普遍特徵,例如:長毛,在寒冷氣候下可起到保暖效果。最終目標是將這個雜交胚胎植入大象體內,並培育至分娩時期。
這項研究頗有希望,但是一些專家認為,丘奇的時間計畫表過於樂觀。即使研究人員能夠培育功能完全的雜交體胚胎,像他預想的那樣,在一個人造子宮中生長發育,仍是一個需要克服的障礙。當然,丘奇的實驗室現在能夠在人造子宮中培育出一個妊娠期一半的老鼠胚胎,大約發育10天左右。但目前並不能保證未來幾年之內能夠見證猛獁的誕生。
4、CRISPR技術可培育更健康的新型食物
CRISPR基因編輯技術被證實在農業研究領域具有發展前途,美國紐約冷泉港實驗室科學家使用CRISPR工具能夠增大番茄產量,該實驗室開發一種方法能夠編輯基因,確定番茄的大小,分枝結構以及最大產量時番茄的外形。
冷泉港實驗室扎卡里·利普曼(Zachary Lippman)教授在一篇新聞稿中稱,農作物的每個特徵能夠以電燈變光開關方式進行控制,目前我們可以使用原生DNA,增強其自然屬性,這將幫助我們突破產量障礙。
滿足飢餓人群的高產農作物僅是一個開始,科學家希望CRISPR技術能夠幫助擺脫轉基因生物(GMOs)的“污名”。2016年,杜邦先鋒農業科技公司宣稱,最新培育一種新品種CRISPR基因編輯玉米,因為研究人員改變了它的基因,因此從技術上講,它並不是轉基因農作物。
轉基因生物和基因編輯作物之間的區別非常簡單,傳統的轉基因生物是通過植入外來DNA序列進入玉米基因,傳遞其特徵或者屬性至未來的有機生物。基因編輯比這種技術更加精確:它對本地基因組的特殊位置基因進行精準改變,經常破壞某些基因或者改變它們的位置,這些都不會引入外來DNA。
雖然轉基因生物在消費者之間存在爭議,但是杜邦先鋒等公司能夠更好地認識基因編輯食物。轉基因生物在美國市場已存在幾十年時間,科學家未探測到任何風險,儘管轉基因生物的最大支持者承認,科學家仍不清楚所有的長期風險。
CRISPR技術編輯的農作物也是如此,當然,科學家將繼續測試和評估這些農作物,從而確保不會出現預料之外的副作用,但是這項早期研究仍具有較大的發展前景。最終,CRISPR技術編輯的農作物很可能快速占據全球市場。
杜邦先鋒農業科技公司希望到2020年將其“蠟質”基因編輯玉米投入美國市場,據悉,一種基因編輯蘑菇已繞過美國農業部的規定,它並不包含來自病毒或者細菌的外來DNA,並成為首個亮綠燈的CRISPR技術編輯生物體。瑞典現已宣布,將對CRISPR技術編輯農作物進行分類和調控,其方法不同於轉基因生物,但是歐盟委員會尚未選定其立場。
CRISPR技術將根除地球最危險的害蟲
像CRISPR的基因編輯技術可以直接對抗傳染性疾病,但是一些研究人員決定通過消除其傳播方式來降低疾病的蔓延擴散。美國加州大學裡弗賽德分校科學家培育出一種蚊子,它們對於CRISPR技術產生的變化非常敏感,這將便於科學家前所未有地控制傳遞至後代的生物遺傳特徵。研究結果顯示,通過改變眼睛、翅膀和角質膜發育的基因,最終培育出身體黃色、三眼、無翅蚊子。
通過打亂蚊子基因多個位置的目標基因,研究小組正在測試“基因驅動系統”,來繼承傳遞這些抑制性特徵。基因驅動是一種本質上確保基因特徵能夠繼承的方式,通過削弱蚊子的飛行能力和視力,加州大學裡弗賽德分校科學家希望大幅降低蚊子在人類傳播危險傳染病的能力,例如:登革熱和黃熱病。
其他研究人員通過阻礙蚊子繁殖能力試圖消滅它們,2016年,倫敦帝國理工學院一組研究人員使用CRISPR技術來研究攜帶瘧疾的雌蚊的繁殖方式,通過基因驅動系統影響雌性不育特徵,使該特徵更有可能遺傳給後代。
但是干擾蚊子的數量可能會帶來無法預料的結果,消滅一個物種,即使是一個看似沒有太多生態價值的物種,也會破壞生態系統的微妙平衡。這可能產生災難性的後果,例如:破壞食物鏈或者增大瘧疾等疾病在完全不同物中之間的傳播擴散。
社會影響
正面
CRISPR在生物醫學研究領域引起一場巨變。不像其他基因編輯手段,它使用起來廉價、迅速且簡單,並因此席捲全球實驗室。研究人員希望利用它調整人類基因以消除疾病,創造生命力更加頑強的植物,並且消滅病原體。
長久以來,生物學家一直在利用分子工具編輯基因組。他們因一種有望精確且高效地編輯基因、被稱為鋅指核酸酶的酶而興奮不已。不過,需要花費5000多美元才能訂購到的鋅指並未被普遍採用,因為它們很難進行基因改造且花費頗高。CRISPR卻大不相同:它依靠一種利用引導性RNA分子將其導向目標DNA、被稱為Cas9的酶,然後編輯DNA以擾亂基因或插入想要的序列。通常,研究人員需要訂購的只是RNA片段,其他成分都是現成的。全部花費只有30美元。這使得該技術走向大眾化,因此每個人都在使用它。這的確是一場巨大的革命。
CRISPR方法快速超越鋅指核酸酶和其他編輯工具。對一些研究人員來說,這意味著要放棄曾花費數年來完善的技術。研究人員傳統上嚴重依賴諸如小鼠、果蠅等模式生物。CRISPR使在更多生物體中編輯基因成為可能。
負面
編輯人類基因的想法往往引發爭議。英國禁止進行人體基因編輯。英國納菲爾德生物倫理學協會副秘書長彼得·米爾斯表達了對扮演上帝和“定製嬰兒”的擔憂。
一項對不能成活的人類胚胎開展的研究(在中國進行)因研究人員發現他們在臨床環境下使用這種技術面臨“嚴重障礙”而被叫停。
此外,在2015年3月,一個研究小組在《自然》雜誌發表公開信,提出“嚴重擔憂”編輯人類基因“種系”產生的道德和安全影響。
一些研究人員仍憂心忡忡,他們認為大量噬菌體侵入人體會引發免疫反應,或導致耐抗生素細菌對噬菌體產生抗藥性,否則就會消滅它們。
在世界上的一些地方,例如:中國,科學家們可以很大程度不受約束地對人類胚胎進行實驗,但在美國、加拿大和英國,情況卻並非如此。
在美國,當前食品和藥物管理局(FDA)並未考慮利用公共資金來研究那些可以遺傳的基因(俄勒岡州研究人員的研究工作並不是以移植為目的,該研究是由私人提供資金)。在加拿大,編輯基因遺傳給後代,是一種犯罪行為,最高刑罰可判處10年監禁。在英國,2016年,人類受精與胚胎管理局授權倫敦一支科學家小組獲得編輯人類胚胎基因的許可,英國科學家希望這將成為一個先例,並打開未來基因編輯套用的大門。