基本介紹
- 中文名:非水溶劑
- 外文名:Aqueous solvent
- 所屬學科:化學
- 種類:液氨、醋酸等
- 套用領域:生物、化學、醫藥等
- 分類:質子溶劑和非質子傳遞溶劑
簡介,非水溶劑的分類,常見重要非水溶劑,液氨,醋酸,套用進展,
簡介
非水溶劑的套用開闢了化學領域中嶄新的研究途徑,並已發展成為現代化學的重要課題之一.大多數在實驗室中觀察到的無機化學反應,主要是在水溶劑中進行的.然而,當以其它溶劑代替水時,卻可以得到與在水中不同的反應結果,許多不能夠在水中發生的化學反應,在其它溶劑中卻可以發生或者向相反的方向進行,這不僅是理論上頗感興趣的問題,而且在工農業生產中也具有重要的意義.不僅如此,有機化學工作者很早就套用非水溶劑進行各種有機合成工作,發展了大量的有機及無機的非水溶劑,HF、H3SO3F等無機物就曾較早的在有機合成中得到套用.生物化學工作者也常用一些非水溶劑來做為某些生物化學反應的介質.冶金工作者對於那些活潑性強的金屬,是不能用電解其鹽的水溶液來製取的,於是發展了熔融鹽的電解來製取鹼金屬、鹼土金屬以及鋁等活潑金屬,使得高溫熔融物體系作為一大類非水溶劑而發展起來.分析化學工作者套用非水溶劑分析測定那些在水溶液中不能進行測定的物質.非水溶劑用於無機合成,主要是用於製取那些在水溶液中不能製備的物質。另外,萃取分離技術也廣泛套用於各種非水溶劑.由於水溶劑的套用日趨廣泛,也促使物理化學工作者對於溶劑和溶液性質進行研究,同時開展了有關物理化學數據的測定和積累工作,以利於指導實踐.因此,套用和研究非水溶劑的化學前景非常廣闊.
非水溶劑的分類
常見的非水溶劑可分為酸性溶劑、鹼性溶劑和非質子傳遞溶劑等三類:
(1)酸性溶劑 又稱疏質子溶劑,這類溶劑的酸性顯著比水強,如甲酸、乙酸、硫酸、氫氟酸、三氯乙酸等。
(2)鹼性溶劑 又稱親質子溶劑,這類溶劑的鹼性顯著比水強,如乙二胺、丁胺、吡啶、液氨等。
(3)非質子傳遞溶劑 它們不產生溶劑化質子,具有較高的介電常數,它們跟加入的酸或鹼無反應,只有當加入第二種酸或鹼時,才能建立起A1+B2←→B1+A2 ① 的平衡。如烴類和它們的鹵素衍生物、三氟化溴、二氧化硫、二氯亞碸、硝基苯等。
注:① "←→" 表示可逆符號。
常見重要非水溶劑
液氨
液氨的親質子性比水強得多,作為溶劑研究得也較多,常被看作是鹼性溶劑的代表。
(1)液氨中的酸鹼反應
液氨的自身離解反應為:

所以在液氨體系中最強的酸和鹼就是NH+4離子和NH-2離子.由於氨的鹼性比水強,所以氨的共扼酸NH+4遠比水的共扼酸H3O+的酸性弱,而其共扼鹼NH-2則遠比水的共扼鹼OH-的鹼性強.因此在水中呈弱酸性的物質,在液氨中呈強酸性.如醋酸在水中為弱酸,在液氨中則表現為強酸,而且可被液氨溶劑拉平[3]為NH+4.銨鹽的液氨溶液與活潑金屬反應,如同酸的水溶液與比較活潑金屬反應一樣產生氫氣。
液氨中鹼類物質可以氨基化鉀(KNH2)為代表(類似水中的NaOH及KOH),由於NaNH2在液氨中溶解度比較小,故多用KNH2與金屬離子反應時常生成金屬的氨基化物、亞氨基化物或氮化物沉澱,這與水中生成的金屬氫氧化物沉澱的反應相類似。
(2)金屬的液氨溶液及其反應
液氨作為溶劑的特異之處是它能夠溶解鹼金屬、鹼土金屬、鋁以及某些稀土等活潑金屬,所得的溶液都呈藍色.把這些溶液稀釋都具有相同的吸收光譜而與溶解的金屬無關.這些金屬的氨溶液還都具有良好的導電性.高濃度時溶液呈古銅色,其導電性接近於金屬.這些現象都曾引起化學家們的莫大興趣,進行了大量的研究。一般認為:
第一是在稀溶液中,金屬原子基本上離解為溶劑化陽離子和溶劑化電子;
第二是隨著金屬濃度的增大,氨合金屬離子有和氨合電子結合的趨勢,形成M2、M3等聚集體或稱簇狀物,此時溶液中未成對電子的百分率減少,溶液的摩爾磁化率隨之降低.
第三是在濃溶液中,氨合金屬離子與氨合電子結合,如同熔融的金屬一樣,其密度低於稀溶液,電導及磁化率也與純金屬接近,故有“稀釋的金屬”之稱.有些金屬的液氨溶液,在一定溫度和濃度範圍記憶體在兩個互不相溶的平衡液相.較重的液相呈藍色,其中金屬的濃度較小;較輕的液相呈古銅色,其中金屬的濃度較大.這種有趣的事實已見於鈉、鉀、鈣、鍶和鋇等金屬的液氨溶液.四是所有金屬的液氨溶液均不太穩定,長期放置或在催化劑如Pt、Fe、Fe2O3等存在時便會分解。
總之,液氨化學類似於水的化學,水中的反應類型在液氨中基本上都可以見到.但液氨的鹼性比水強,介電常數比水小,造成它與水的差別.液氨中活潑金屬的溶液可以用來進行許多還原反應,是液氨作為溶劑的特殊優越之處。
醋酸
醋酸是一種良好的疏質子溶劑.從醋酸的結構簡式來看,其分子並無對稱結構,但奇怪的是測得這個分子結構不對稱的化合物偶極矩竟然等於零,這可以看作是兩個醋酸分子通過氫鍵締合成具有對稱結構的二聚體的結果,從而抵消了兩個分子的偶極.有些溶劑能促使這個二聚體離解,形成相應的溶劑化物,其中溶質和溶劑間的作用主要是氫鍵的作用.由於這一特徵,加上介電常數小,所以,溶於醋酸中的電解質不易形成完全離解的離子,而較易形成離子對。 醋酸
醋酸
 醋酸
醋酸醋酸對不同酸的區分效應[8]與水相比要強得多.HClO4、HBr、HCl、HNO3等在水中的強度表現為相同的強酸,而在醋酸中卻有明顯的酸強度差別,這是由於醋酸親質子性能比水弱得多造成的.醋酸對鹼的拉平效應與水相比顯然要強得多,所以在水中呈強鹼性的物質,在醋酸中都會被拉平為Ac-離子。
醋酸對於有機化合物是良好的溶劑,並廣泛地用作那些要求酸性比水強而在水中又不能發生的反應介質。
套用進展
(1)改變溶劑使一些在水中不能發生的反應得以發生以至向相反的方向進行
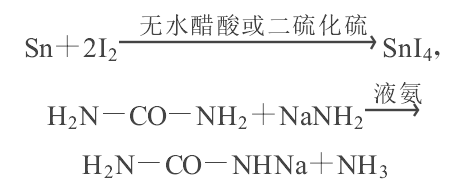
例如,四碘化錫(SnI4)以及尿素鈉鹽(H2N- CO- NHNa)遇水便立即水解,因而不能在水中製備和分離.但是前者可以用無水醋酸或二硫化碳為溶劑.用碘和金屬錫直接反應來製備;後者可以用液氨為溶劑,由尿素和氨基化鈉反應來製取,這兩個反應分別為:
(2)套用非水溶劑製備無水鹽
無水氯化物常用於熔融鹽電解以製取活潑的金屬.套用氯化亞硫醯(SOCl2)做溶劑,常可以得到滿意的無水氯化物,這是由於發生下列的反應而可以除去水:

無水硝酸鹽的製備更為困難.除了鹼金屬和銀的硝酸鹽是無水晶體外,幾乎所有的硝酸鹽都帶有結晶水.過渡金屬的硝酸鹽幾乎不能用加熱脫水獲得無水鹽.利用非水溶劑,則可以比較方便的製備一些硝酸鹽。
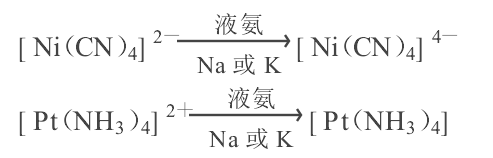
(3)利用非水溶劑製備某些異常氧化態的特殊配合物
例如在液氨中可利用金屬鈉或鉀的強還原性發生下列的反應:
(4)改變溶劑可以改變某些反應的速度,例如反應:

在二氧六環中以一定的速度進行.如果在苯中進行其速度可以增加80倍,在丙酮中進行可以加快500倍,在硝基苯中進行可以加快2800倍。

