基本介紹
- 中文名:電解產物
- 外文名:Electrolyte product
- 理論基礎:電化學原理
- 方法:電解
- 分類:陽極電解、陰極電解
- 套用:電鍍、精煉粗銅
電解產物顧名思義即通過電解反應得到的生成物。如果電解的是熔融鹽,電極採用鉑或石墨等惰性電極,電極產物只可能是熔融鹽的陽、陰離子分別在陰、陽兩極上進行還原和...
電解(Electrolysis)是將電流通過電解質溶液或熔融態電解質,(又稱電解液),在陰極和陽極上引起氧化還原反應的過程,電化學電池在外加直流電壓時可發生電解過程。利用在...
電解引發(electrolytic initiation)又稱“電化學引發”。用電解的方法產生自由基或離子活性種引發烯烴聚合的引發方法。不同的電解質和不同的烯烴單體,用電解方法可以...
電解水通常是指含鹽(如硫酸鈉,食鹽不可以,會生成氯氣)的水經過電解之後所生成的產物。電解過後的水本身是中性,可以加入其他離子,或者可經過半透膜分離而生成兩種...
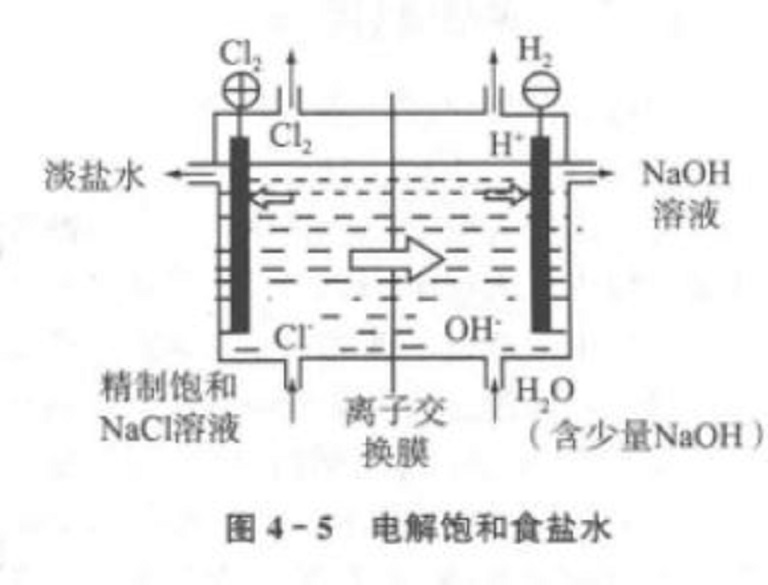
在上面的電解飽和食鹽水的實驗中,電解產物之間能夠發生化學反應,如NaOH溶液和Cl2或Cl離子接觸會生成NaClO與NaCl,H₂和Cl₂混合遇火或光照能發生爆炸。在工業生產...
基於電解過程中的陽極溶解原理並藉助於成型的陰極,將工件按一定形狀和尺寸加工成型的一種工藝方法,稱為電解加工。...
電解方法是加直流電壓於電解池兩個電極上,使電解質溶液(或熔鹽)通過電極發生氧化還原反應的方法。通電時,溶液(或熔鹽)中的正離子移向陰極,發生還原反應;同時,負...
電解池的主要套用用於工業制純度高的金屬,是將電能轉化為化學能的一個裝置(構成:外加電源,電解質溶液,陰陽電極)。使電流通過電解質溶液或熔融電解質而在陰,陽...
電解制氧技術是指利用水電解法製取氧氣和氫氣的技術。電解制氧技術構成再生式生命保障系統氧循環迴路的閉合,電解產生的氧氣供給航天員呼吸,氫氣回輸到二氧化碳還原系統...
電解鋁就是通過電解得到的鋁。現代電解鋁工業生產採用冰晶石-氧化鋁融鹽電解法。熔融冰晶石是溶劑,氧化鋁作為溶質,以碳素體作為陽極,鋁液作為陰極,通入強大的直流電...
電解聚合(electrolytic polymerization;electrochemical polymerization)是由電極反應誘發的聚合反應。含有支持電解質(如硝酸鈉等)和單體的水溶液或有機溶劑(如DMF、...
在陰極和陽極上同時獲得兩種不同固體有價電解產物的電解,也稱同時電解。雙金屬電解通常是在隔膜電解槽(見隔膜電解)中進行的,Zn—MnO2同時電解可作為這種電解工藝的...
電解槽由槽體、陽極和陰極組成,多數用隔膜將陽極室和陰極室隔開。按電解液的不同分為水溶液電解槽、熔融鹽電解槽和非水溶液電解槽三類。當直流電通過電解槽時,...
電解處理法是將電能轉化成化學能使電解槽內電極附近產生氧化還原反應,從而使廢水得以淨化的過程。這種水處理法包括電極表面上的電化學作用、間接氧化和間接還原作用(...
電解工,是一種從事車間電解行業的工人,他們一般在溫度高達40度的車間內作業。主要從事換(陽)極、封(陽)極、電解質/鋁水平調整等作業。...
隔膜電解法是用可滲透的多孔隔膜將電解槽內的陰極和陽極分開的電化冶金作業。隔膜將電解槽分隔成陽極室和陰極室,陽極和陰極分別放置其中。兩室的電解液可以一樣,...
隔膜電解技術是把電滲透技術和電解技術結合在一起的具有綜合功能特性的技術。它廣泛地套用在化工、環保、有色冶金等領域。由於它充分利用兩電極之反應, 並將陽極區...
光電解(Photoelectrolysis)是利用半導體吸收光而產生電流,再利用這電流將水電解成氫和氧氣的制氫方法。光電解法是可再生能源氫生產效率最高的方法,它可把太陽能轉換...
電解拋光(electro-polishing)也稱電拋光,是利用陽極在電解池中所產生的電化學濟解現象,使陽極上的微觀凸起部分發生選擇性溶解以形成平滑表面的方法,該技術能很好地...
電解液是一個意義廣泛的名詞,用於不同行業其代表的內容相差較大。有生物體內的電解液(也稱電解質),也有套用於電池行業的電解液,以及電解電容器、超級電容器等行業...
《濕法冶金·電解技術》內容共分9章,按照工作過程系統化的思路,在介紹電解技術基礎知識後,簡明扼要地介紹了銅、鉛、鋅、錫、鎳、銀、金等金屬電解生產的精煉原理...
鎳電解(nickel electrolysis)是指採用電化冶金方法從鎳冶煉中間產品製取純鎳或金屬鎳的過程。鎳冶煉中同產品可為粗鎳、硫化鎳或含鎳溶液,用粗鎳或硫化鎳作為可溶...
電解水實驗是一個測試水的組成的實驗。根據電解時生成物的情況,電解可分為電解水型、分解電解質型、放氫生鹼型、放氧生酸型等幾種類型。水由氫、氧兩種元素...
電解磨削(electrochemical grinding)電解作用與機械磨削相結合的一種特種加工,又稱電化學磨削,英文簡稱ECG。電解磨削是20世紀50年代初美國人研究發明的為電解磨削的原理...
電解引發聚合,在電解液中除單體外還要添加聚合引發劑(也有單體兼作的場合)。引發劑在電解反應中產生活性中間體(自由基,陰離子、陽離子等),此作用於單體引起聚合。...
工業上用電解飽和NaCl溶液的方法來製取NaOH、Cl2和H2,並以它們為原料生產一系列化工產品,稱為氯鹼工業。氯鹼工業是最基本的化學工業之一,它的產品除套用於化學工業...
