電化學位能用來表述電沉積過程中陰極反應所需能量,當金屬電極置於電解液中時,在金屬與電解液截面形成所謂雙電層而產生電位差,該值稱為金屬在它的鹽溶液中的電位,亦為金屬給出電子能力的電化學位能。平衡電位取決於溶液中離子的濃度或活度和溶液的溫度,一般把在25℃下含有單位離子活度的電位稱為標準電極電位,通常用ψ°表示。不同金屬的標準電極電位是不同的。當金屬電極置於含有同種金屬離子的電解液中,金屬與該溶液之間就進行離子交換,交換達到平衡時的電極電位稱為金屬的平衡電位。電沉積必須靠外部電源給系統提供能量,因此,必須給系統通以電流。所謂極化,是當電流通過電極時,電極電位偏離平衡電位的現象。極化現象使陰極電位從原來的平衡電位向負方向移動,從而使陰極獲得過電位。
基本介紹
- 中文名:電化學位能
- 外文名:electrochemical potential
- 套用領域:電化學
- 作用:表征金屬給出電子的能力
相關概念——電沉積
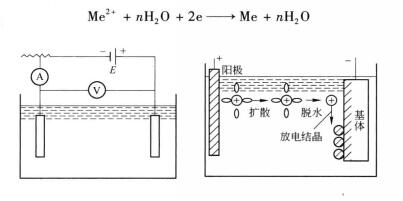 電沉積示意圖
電沉積示意圖