基本介紹
- 中文名:雷德利希-鄺氏方程
- 外文名:Redlich-Kwong equation of state
簡介,Redlich—Kwong方程,索阿維對雷德利希-鄺氏方程的修正,
簡介
方程的一般形式為:

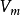
R-K方程對烴類等非極性氣體精度較好,且適用的溫度、壓力範圍較寬。不過對極性氣體一般不適用。
R-K方程中的 不同於范德瓦耳斯方程中的常數。兩常數值可通過實驗數據回歸求得,缺乏實驗數據時也可由氣體的臨界點數據求得:
不同於范德瓦耳斯方程中的常數。兩常數值可通過實驗數據回歸求得,缺乏實驗數據時也可由氣體的臨界點數據求得:



Redlich—Kwong方程
- {\displaystyle {p={\frac {R\,T}{V_{m}-b}}-{\frac {a}{{\sqrt {T}}\,V_{m}\left(V_{m}+b\right)}}}}
- {\displaystyle a={\frac {0.42748\,R^{2}\,T_{c}^{\,2.5}}{p_{c}}}}
- {\displaystyle b={\frac {0.08662\,R\,T_{c}}{p_{c}}}}
雷德利希-鄺氏方程於1949年被提出,是對於當時其他物態方程的一個較大的改進形式。由於它相對簡單的數學形式,它仍然引起了很多人的興趣。雖然比范德華方程更優越,但是因為它在涉及液相的情況里表現得不太好,因此不能用於精確計算氣液平衡。然而,它仍然可以在涉及單獨的液相的情況里發揮作用。
當壓強對臨界壓強的比值小於溫度對臨界溫度比值的一半時,即:
- {\displaystyle {\frac {p}{p_{c}}}<{\frac {T}{2T_{c}}}.}
雷德利希-鄺氏方程能夠充分勝任計算氣相屬性。
索阿維對雷德利希-鄺氏方程的修正
- {\displaystyle p={\frac {R\,T}{V_{m}-b}}-{\frac {a\,\alpha }{V_{m}\left(V_{m}+b\right)}}}
- {\displaystyle a={\frac {0.42748\,R^{2}\,T_{c}^{2}}{P_{c}}}}
- {\displaystyle b={\frac {0.08664\,R\,T_{c}}{P_{c}}}}
- {\displaystyle \alpha =\left(1+\left(0.48508+1.55171\,\omega -0.15613\,\omega ^{2}\right)\left(1-T_{r}^{\,0.5}\right)\right)^{2}}
- {\displaystyle T_{r}={\frac {T}{T_{c}}}}
這裡,{\displaystyle \omega }是該種物質的偏離係數。索阿維修正的原始形式為:
- {\displaystyle \alpha =\left(1+\left(0.48+1.574\,\omega -0.176\,\omega ^{2}\right)\left(1-T_{r}^{\,0.5}\right)\right)^{2}}
在1972年,索阿維(G. Soave)將雷德利希-鄺氏方程中的1/√(T)項替換為一個與溫度和偏離係數有關的函式α(T,ω),替換後的方程也被稱作“索阿維-雷德利希-鄺氏方程”。引入α函式是為了與烴的蒸發壓強相適應,事實證明這個方程在這些物質的相關計算中更加精確。
