鐵的氰合配合物(化學)(cyano complex of iron) 主要為亞鐵氰根FeⅡ(CN)忹和鐵氰根FeⅢ(CN)咶 配陰離子(見配位化合物)的酸和鹽。 亞鐵氰化物 為含亞鐵氰根離子的鹽和酸。亞鐵氰根離子為穩定和無毒的配陰離子,能與許多金屬生成鹽類 ,其中以鉀鹽最重要。鹼金屬和鹼土金屬的鹽能溶於水,其他金屬的鹽通常難溶於水。 亞鐵氰化物化學基礎知識: 亞鐵氰化鉀經氯氣或電解氧化,可得鐵氰化鉀K3[Fe(CN)6],為紅棕色晶體,也稱赤血鹽,其密度為1.85克/厘米3(25℃);強烈加熱會分解;不溶於乙醇,溶於丙酮和水,4℃時在100克水中可溶33克;是鐵氰化物中最重要的鹽。鐵氰化鉀與過量的亞鐵鹽作用,得到結構複雜的滕氏藍沉澱,其結構與普魯士藍相同,都是K[FeⅡ(CN)6FeⅢ]。
基本介紹
- 中文名:鐵的氰合配合物
- 外文名:cyano complex of iron
正文
亞鐵氰化物 為含亞鐵氰根離子的鹽和酸。亞鐵氰根離子為穩定和無毒的配陰離子,能與許多金屬生成鹽類,其中以鉀鹽最重要。鹼金屬和鹼土金屬的鹽能溶於水,其他金屬的鹽通常難溶於水。
亞鐵氰化鉀K【Fe(CN)】·3HO又稱黃血鹽,為黃色晶體,密度為1.85克/厘米(17℃),70℃時失去所有結晶水。無水亞鐵氰化鉀為白色粉末,不溶於醇、醚和氨,溶於丙酮和水,12℃時100克水可溶27.8克無水鹽。無水鹽經強烈灼燒則分解:
亞鐵氰化鉀在水溶液中很穩定,幾乎檢驗不出Fe、CN離子;長時間加熱,特別是在光照下,導致水合作用而產生【Fe(CN)·HO】和劇毒的氰化氫HCN;遇熱的稀硫酸則配陰離子分解,析出HCN;遇濃硫酸則氰根被氧化成一氧化碳。亞鐵氰化鉀與過量的三價鐵鹽作用,得到結構複雜的普魯士藍沉澱,是一種重要的顏料。將乾血、鐵屑和碳酸鉀共熱得到含氰化鉀和硫化鐵的固體,用熱水處理即可得亞鐵氰化鉀:
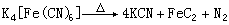 鐵的氰合配合物
鐵的氰合配合物鐵氰化物 為含鐵氰根離子的鹽和酸,鐵氰根比亞鐵氰根容易發生水合作用而產生HCN,因此有毒。鐵氰根離子也能與許多金屬形成鹽,它的鹼金屬鹽、鹼土金屬鹽溶於水,而其他金屬鹽通常難溶於水。鐵氰根與稀硫酸作用產生HCN;與濃硫酸反應時氰根被氧化成一氧化碳。在鹼性溶液中鐵氰根為強氧化劑,可將三價鉻氧化成鉻酸根。
亞鐵氰化鉀經氯氣或電解氧化,可得鐵氰化鉀K【Fe(CN)】,為紅棕色晶體,也稱赤血鹽,其密度為1.85克/厘米(25℃);強烈加熱會分解;不溶於乙醇,溶於丙酮和水,4℃時在100克水中可溶33克;是鐵氰化物中最重要的鹽。鐵氰化鉀與過量的亞鐵鹽作用,得到結構複雜的滕氏藍沉澱,其結構與普魯士藍相同,都是K【Fe(CN)Fe】。
鐵氰酸H【Fe(CN)】為棕黃色針狀晶體;50~60℃分解;溶於水、醇,不溶於乙醚;在水溶液中為三元強酸。它可由鉀鹽與濃鹽酸作用製得。
