基本介紹
解釋,實驗目的,實驗器材,實驗步驟,實驗原理,實驗用途,注意事項,
解釋
基本解釋:能形成銅鏡的反應,由硫酸銅與氫氧化鈉反應,生成氫氧化銅,再用甲醛還原,即有紅色的銅沉澱產生,在試管壁上形成銅鏡。 銅鏡反應
銅鏡反應
 銅鏡反應
銅鏡反應詞語分開解釋:銅鏡 : 古代用來照映形象的銅製鏡子。一般是圓形,照面的一面磨光發亮,背面常鑄花紋。中國最早的銅鏡出現於新石器時代,戰國時已很盛行。
實驗目的
研究生成金屬鏡的條件,掌握相關的實驗操作。
實驗器材
舉例:
試管、試管夾、酒精燈、培養皿、台秤、角匙、石棉網、10%氫氧化鈉溶液、5%硝酸銀溶液、0.5M氨水、6M氨水、固體硝酸銀(cp)、7%硫酸銅溶液、6M鹽酸、3%葡萄糖溶液、37%甲醛溶液、*甲酸鈉溶液、**酒石酸鉀鈉溶液、銀氨溶液、10%氯化亞錫溶液。
甲酸鈉溶液:10g氫氧化鈉置於燒杯中,慢慢滴定4.5ml甲酸鈉溶液(邊滴邊攪拌),加100ml蒸餾水即成。
酒石酸鉀鈉溶液:四水酒石酸鉀鈉8g和氫氧化鈉2.6g加到20ml蒸餾水中。
銀氨溶液:試管中加1 ml 5%硝酸銀溶液,加1滴5%氫氧化鈉溶液,在不斷振盪下滴加稀氨水至沉澱剛好溶解為止。
10%氯化亞錫溶液 : 秤取2克氯化亞錫,先溶於少量6M鹽酸中,再稀釋至20ml。
實驗步驟
簡單來說,就是洗燒杯—敏化—鍍銀鏡—鍍銅鏡(因為銅不容易附著在燒杯上故需先鍍一層銀鏡)
具體:
1、用肥皂洗淨手,用去污粉將培養皿擦洗乾淨,再把洗滌劑放在小燒杯中加水溶解,加熱至80℃,將它倒入培養皿中,靜置冷至室溫,傾去後分別用水和蒸餾水全面淋洗,備用。
2、將20ml氯化亞錫溶液倒入培養皿中,靜止5分鐘後傾去,用蒸餾水小心淋洗,待乾。
3、在50ml燒杯中加入2滴5%硝酸銀和1滴氫氧化鈉溶液,逐滴加入0.5M氨水至沉澱剛好溶解,加入15 ml蒸餾水,攪拌後再加入3ml 3%葡萄糖溶液,混合後立即倒入培養皿中,靜置5分鐘,當溶液呈棕色後傾去,用蒸餾水小心淋洗,再用烘箱烘乾或晾乾。
4、50ml燒杯中充分混合等體積(約各7ml )7%的硫酸銅溶液、酒石酸鉀鈉溶液和37%甲醛溶液。立即倒入培養皿中,靜置5分鐘即可形成銅鏡。
實驗原理
從標準電極電勢值可知:Cu2+,Ag+, Hg2+,Hg22+和相應的化合物具有氧化性,均為中強氧化劑。
銅鏡反應方程式:2Cu2++3HCHO+7OH-===2Cu+3HCOO-+H2+4H2O
實驗用途
舉例:
鞏固硝酸鹽分解、乙醛性質等知識,培養學生的觀察能力和實驗能力。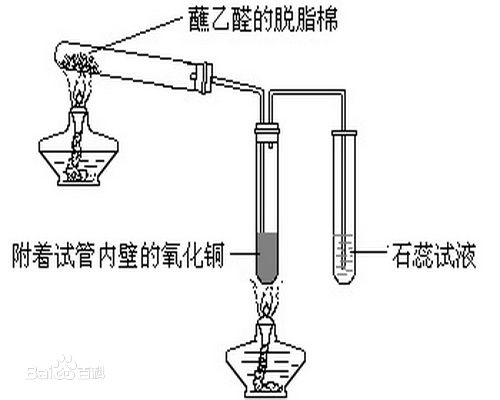

注意事項
舉例:
1.溴乙烷在純水中水解很微弱,在溴乙烷中直接加入稀硝酸和硝酸銀溶液,不出現淺黃色沉澱,即用硝酸銀試劑檢驗不出有Br-存在。
2.溶液必須先酸化(即稀硝酸的量要加足),再加入硝酸銀溶液,否則Ag+在鹼性條件下遇OH-會變黑,干擾檢驗Br-的反應。(注意化學情景,有一些反應必須在鹼性情景下進行的,如銀鏡反應、銅鏡反應,以及鹼性電池等,有些要在酸性情景下進行,如高錳酸鉀酸性溶液、洗液、鉛蓄電池,以及該反應等。

