研究對象
直接測定恆容過程熱效應QV(ΔU)和恆壓過程熱效應QP(ΔH)的實驗方法稱為量熱法。量熱法是熱力學實驗中的一個基本方法。通常能直接測定的熱效應,有物質的熱容、溶解熱、稀釋熱、中和熱和燃燒熱等,測定這些熱效應,還可求算某些化合物的生成焓。物質變化過程中的熱量值,在化工設計和生產實際中都有重要意義,熱效應的數據常用於計算平衡常數和其他熱力學量。熱力學第一定律是量熱測定的基礎,熱量測量的設計原理是:在絕熱條件下,將被測物質置於某一量熱體系中進行反應,它的熱效應使體系的溫度升高或降低,測量反應前後溫度的變化△丁及體系的熱容C,根據熱力學第一定律即可計算反應的熱效應。
量熱法所研究的對象,是在具體過程中所發生的能量變化,它通常以熱的形式存在。熱是人們從遠古以來就常見的現象,但是對於熱的本質,直到1840年左右還沒有弄明白。十八世紀末葉,大多數科學家接受了熱質論。熱質論將熱看作一種假想流體,在熱傳導過程中,它由熱物體流向冷物體,由熱物體失去的熱質的量等於冷物體獲得的量。這種理論認為熱質的總量在所有過程中守恆,因而當物體在高溫時所含的熱比冷卻下來後所含的熱要多。英國科學家Joule在1840年進行了一系列有關熱-功轉化的實驗,證明物體由於受熱面發生的變化,在沒有熱量傳遞的情況下通過對物體作機械功也同樣能發生。最典型的實驗便是對液體用攪拌的方法,使機械能轉化為內能,也可使液體的溫度升高,此過程中並沒有熱質流入液體。Jouler的實驗結果宣告了熱質論的破產,證明了熱與功一樣,都是能量的一種形式。熱和功是可以相互轉換的,並測定出熱—功當量的具體數值。在焦耳工作的基礎上,德國科學家Helmhohz於1847年首次明確地提出能量守恆原理,即熱力學第一定律。
熱力學第一定律的建立使人們對於熱的本質具有更清晰、更正確的認識。根據熱力學第一定律,熱是當不同物體之間因有溫度的差別而進行交換或傳遞的能量,只有當存在溫度差時,才有熱的傳遞。如果物體之間溫度相等,則沒有熱量的傳遞,熱只在被傳遞的過程中存在,因而熱是一種過程量。一個物體在熱的時候比在冷的時候具有更多的能量,而不能說具有更多的熱量。
被研究的系統若經歷了某一過程,從一種狀態(始態)變化到另一種狀態(末態),系統與周圍環境之間多少都有能量的交換,使系統的內能發生變化。系統與環境之間所交換的能量,有熱(因溫差的存在而傳遞的能量)和功(其他途徑所傳遞的能量)兩種形式。而熱量計則是用來測量這種能量變化的儀器。
熱量計於十九世紀末已經開始得到套用。它是研究各種過程中能量變化的有效手段,熱量計在科學研究及工業套用技術等領域均具有廣泛的套用,而且,其本身也正在不斷地改進和完善,在熱量計的發展過程中,採用了許多先進的現代技術,使其變得更精確、更靈敏,套用範圍更廣泛。
原理
根據熱力學第一定律,系統中內能的變化等於對外界所做的功,在恆容條件下,其絕熱功為ΔU=QV;在恆壓條件下,ΔH=QP。系統的內能U和焓H都是不可能測定的量,但是系統從狀態1到狀態2之間的內能差ΔU和焓差ΔH可以用量熱的方法測得。
量熱是使欲測定的反應在熱容量已知的儀器-量熱計中進行,從反應過程中量熱計溫度的變化來量度反應的熱效應,即將熱當量K乘以溫度變化值,由此就可直接得出反應的熱效應(Q=KΔt)。因此,要測量的量是實驗過程中溫度的變化Δt和量熱計的熱當量K,另外還需要準確地確定參加反應的物質的數量和狀態。
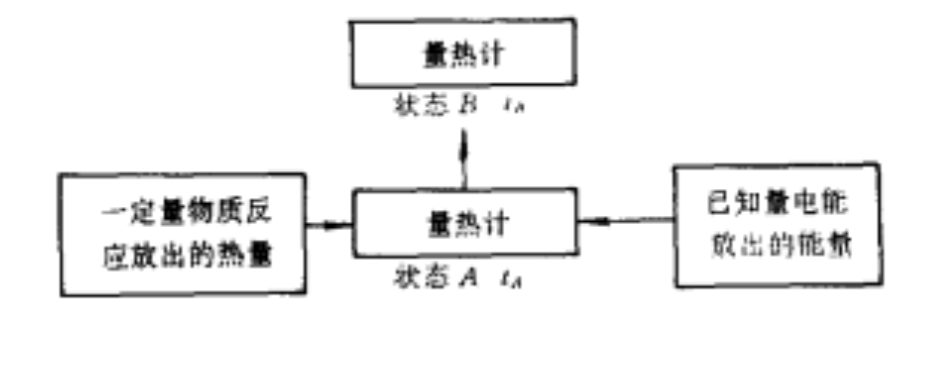 測定放熱反應熱原理示意圖
測定放熱反應熱原理示意圖近代量熱方法的基本原理,主要是在一個量熱計內,將一定量物質在化學變化或物理變化中所吸收或放出的熱量,與一定量電能或已知反應放出的熱量相比較,此原理可用上圖來說明。圖中A代表量熱計的初態,溫度為tA。B代表量熱計的末態,溫度為tB。設一反應為放熱反應,當一定量物質在量熱計內反應後,量熱計的溫度由初態tA升至末態tB,放出熱量為Q,則:
因為近代電能測量能夠達到很高程度的準確性,為了測定量熱計熱當量尺,在同一量熱計中輸入一定量的電能Qe使量熱計溫度由同一初態tA升到同一末態tB。
上述量熱原理,同樣適用於吸熱反應,此時,只是在反應進行時不斷輸送一定量電能,使量熱計的溫度始終保持不變。則當反應完了後,所輸入的電能就等於反應吸收的熱量,其原理如下所示:
 量熱法原理
量熱法原理量熱計
量熱法所用的主要儀器是熱量計。熱量計的種類很多,從不同的角度出發,對熱量計可進行不同的分類。
從研究對象而言,熱量計可分為兩大類:一類是測量有化學反應過程熱效應的熱量計;另一類則是測量無化學反應發生的物理過程熱效應的熱量計。第二類熱量計最廣泛的用途是測量各種物質在不同溫度範圍的熱容和焓變。焓變的測量中還包括各種相變潛熱,如揮發、熔解以及固體的晶形轉變等等,這些相變一般都可以認為是在可逆條件下進行的。對於純物質,若測定出其從低溫到高溫範圍的焓變和熱容,由這些熱數據可以直接汁算出物質的規定焓和規定墒。反應熱量計的研究對象是有化學反應發生的系統。凡在熱量汁中進行的化學反應均為不可逆過程,因而,這類熱量計通常只能測得化學反應的焓變或內能的變化,只有某些熱量計(如滴定熱量計)才可能在合適的範圍內,通過對熱譜曲線的處理,求算出反應的Gibbs自由能和墒的變化。反應熱量計所研究的化學反應包括:固態、液態及氣態物質的燃燒反應、液—液相反應、氣體或固體在液體中的溶解熱,液體物質的混和熱等,現代量熱法的研究領域還擴展到生物化學及農業等學科,如生物活性的監測,種子生長過程等。
按熱量計的測量原理,又可分成兩類:補償式熱量計和測量溫度差的熱量計。在進行量熱實驗時,反應系統的變化過程所伴隨的能量變化會引起量熱系統溫度的變化,補償式熱量計則是設法對反應過程的能量變化進行補償,使量熱系統的溫度一直維持不變,測量過程中所補償的能量即等於反應系統所釋放的能量。能量補償的方法又可分為相變補償、Peltier效應補償和化學反應補償等方法,但後兩種補償方法已很少採用。測量溫度差的熱量計又分為兩類:一類是測量系統溫度隨時間的變化,要測定反應系統能量的變化,還必須測定系統的熱容。另一類則測量不同位置的溫度差,從而測量系統能量變化值,這類熱量計多為熱導式熱量計。
按照熱量計的操作類型,又可分為四種不同的類型:
等溫熱量計,即在測量時,量熱腔與環境的溫度保持不變,相變熱量計是典型的等溫熱量計;
具有恆定溫度環境的熱量計,這種熱量計的量熱腔與環境之間具有良好的隔熱層,但或多或少有“熱漏”存在。一般的反應熱量計、彈式熱量計等均屬於這類熱量計:
熱導式熱量計,在進行測量時,這類熱量汁的溫度變化很小,且反應前後溫度相等,因而基本上可以認為熱導式熱量計是在等溫條件下進行測定的;
掃描式熱量計,其環境與系統的溫度隨時間按事先規定的程式而變,如恆速升溫等,其量熱系統由被測體系和參考體系組成,各種熱分析儀均屬於這類熱量計。
熱量計雖可按不同的考慮作不同的分類,但這些分類並無絕對的界限,以下對各種熱量計分別加以介紹。
絕熱熱量計
一個理想的絕熱熱量計,在進行量熱實驗時,反應系統與環境之間應沒有熱量的交換,欲達到這個要求有兩種方法:一是使量熱腔與環境的溫度完全相等,另一種方法則是使量熱腔與環境間的熱阻為無窮大,使兩者之間沒有熱的交換,但在實際操作中,完全隔熱是無法辦到的,因而,絕熱熱量計均採用第一種方法,使量熱腔與環境溫度儘可能一致,以達到近乎絕熱的目的。典型的絕熱熱量計原理方框見下圖。在進行量熱實驗時,被測試的樣品若釋放熱量,將會使量熱腔整體溫度升高,用以感測絕熱壁與量熱腔之間溫差的熱電偶會立即感測到溫度的變化並立即將此溫差信號傳至控溫系統,控溫系統根據溫差信號的強弱來控制安裝在絕熱外殼中的電加熱器加熱功率的大小,使絕熱壁的溫度也隨之上升,與量熱腔外殼的溫度保持一致,在整個測量期間,控制絕熱外殼的溫度均不斷地跟蹤量熱腔的溫度,使兩者儘可能保持一致,此外,量熱腔與絕熱壁之間也具有良好的隔熱層,因而在量熱過程中兩者之間的熱交換是極小的,可認為基本上是在絕熱條件下操作。但在實際上,控溫系統不可能作到使量熱腔與絕熱壁的溫度絕對地保持相等,總會有所波動,這種溫度的波動總會帶來少量的熱的交換,因此在對實驗結果進行處理時,應對這少量的“熱漏”進行適當的修正。
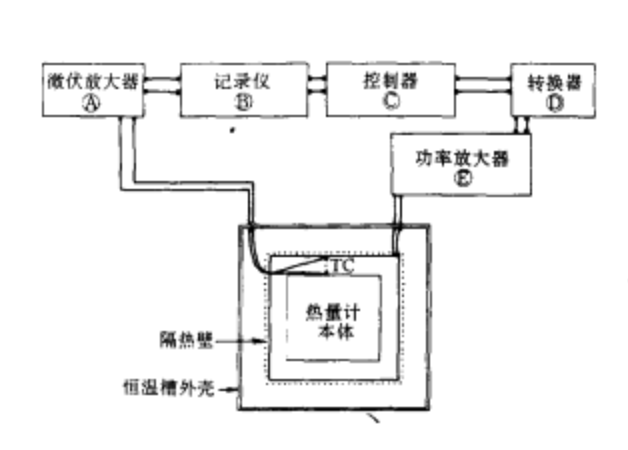 絕熱熱量計原理圖
絕熱熱量計原理圖絕熱熱量計常用來測定物質的比熱,測量範圍可從低溫到高溫,在低溫範圍內(10-350K)。熱量計的絕熱外殼與量熱腔之間常設有真空夾套,以減少因氣體的導熱和對流而帶來的“熱漏”。在高溫範圍內,產生“熱漏”的主要因素是熱的輻射,對流和導熱的影響相對要小一些
等溫熱量計
熱電補償熱量計是一種等溫熱量計,但不是用相變熱進行補償,而是利用熱電效應進行能量補償。若被測量的系統釋放熱量時,利用Peltier效應,用冷端進行能量補償,使反應系統的溫度維持不變。系統放出的熱量可由Peltier效應的致冷量求出。
兩種不同的導體連成迴路,在迴路中用直流電源維持一定電流不斷流過時,則導體的一個結頭變冷,而另一個結頭變熱,這種現象便是Peltier效應,其冷端可以吸收熱量,熱端可放出熱量。對於放熱反應,可用Peltier效應的冷端進行能量補償,但對導體自身而言,因電流的通過而存在因電阻引起的熱效應,即Joule熱效應。Joule效應與Peltier效應是相反的,一為吸熱另一個為放熱,Joule熱效應與電流的平方成正比,而Peltier效應只與電流的一次方成正比,因此,當電流大到某一極限值I0時,兩個效應的值相等,總的表觀是冷端既不放熱也不吸熱。只有當電流小於I0時,才能致冷,當電流量為0.5I0時,致冷效果最顯著,其致冷量為0.25ηI0,η是Peltier係數,與兩種導體的性質有關,Peltier效應的致冷作用受到材料及電流等多種因素的限制,一般說來,其致冷量是不大的。
套用
數據的測定
純物質熱力學數據的測定是量熱法最重要的套用領域之一。用量熱法測定在298.16K和標準壓力下各種化學反應的熱效應,便可得到物質的標準生成焓。通過測定等容和等壓過程的熱效應,可獲得物質的內能和焓的變化值。對純物質,用量熱法測定其從低溫到高溫各溫度範圍內的比熱容Cp,以及在各相變點的可逆相變潛熱,便可由熱力學第三定律直接求出純物質的規定熵,這樣由量熱法求得的熵也稱為量熱熵,由物質的規定焓和規定熵的數值,就可以獲得純物質的規定Gibbs自由能。在用量熱法測定物質的規定熵時,最低溫度可測至幾K的低溫。更低溫度範圍內的熱力學函式值通常可由Debge比熱公式計算求出。
各種物質的比熱容、相變潛熱和諸如稀釋、溶解、混合及吸附等物理過程的熱效應,基本上是用量熱法測定的,這些物性數據,已被製成各種各樣的表格,供人們查閱使用。這些最基本的數據不論對於科學研究還是工業生產都是必不可少的,在化工、冶金等工業領域,在建立任何一套生產裝置之前,都必須進行工程設計,而設計最基本、最初的程式是要對整個工藝流程進行仔細的物料衡算和能量衡算,物料與能量的衡算正確與否,對於整個工程設計的成敗是至關重要的。在進行能量衡算時,則需要有關化學反應的焓變、原料及產物的比熱容、相變潛熱等等各類數據。在選擇工藝流程、確定生產操作指標、估算生產最大產率等方面,物質的熱力學數據都是很重要的。
量熱法在工業方面的另一重要用途是測定各種能源原料的發熱量,這些原料有:原油及天然氣、各不同產地的煤,石油工業的系列產品如汽油、煤油、柴油、液化石油氣及其他燃料等。燃料產品發熱值的大小是鑑定原料質量高低或判定產品是否合格的重要依據。出售燃料產品的廠商須對其產品的發熱值給出最低保證值,因此,在燃料工業上廣泛地採用熱量計來測定產品的發熱量,以保證產品的質量。
隨著人們生活水平的提高,對自身攝入的營養愈來愈講究,為了保持人體處於良好的能量平衡狀態,必須對所攝入食物的能量作準確的計算。因此,量熱法已廣泛用來測量各種食物的發熱值。人們便依據這些數據制定食譜以保證每天攝入適當的能量。同樣,在畜牧場內,也依據這些數據為家畜配制飼料。用量熱法研究易爆易燃等危險化學品的性質,對如何安全的處理和運輸這些化學品是十分重要的。
熱分析熱滴定
掃描式熱量計,特別是熱分析儀器的套用領域已遠遠超出量熱的範圍,在動力學和測定物質理化性質方面,已得到廣泛的套用。
套用差熱分析熱譜曲線,可鑑定各種物質,不論是無機物還是有機物,都具有特徵的DTA曲線,它們像“指紋”一樣表征物質的特性,目前已出版了各種化合物的標準熱分析曲線圖譜集,以便於鑑別礦物、無機物、有機物及高聚物等化合物。
套用DTA和DSC可測定固體及液體的比熱容、液-固及氣-液等一級相變的相變溫度和相變熱以及各類二級相變如固態晶形轉變、磁性轉變和玻璃化轉變的轉變溫度等。
礦物、無機鹽類以及有機化合物在高溫下會發生分解,將TDA、DSC和TG法聯用,可以對化合物熱分解反應的溫度、產物、分解速率、反應活化能和反應機理進行測定和分析。Freeman和Caroll於1958年提出了從熱重曲線求反應級數和活化能的方法,後來,Sharp和Doyle等人也提出各自的處理方法。
熱分析很早就套用於金屬學領域,用來測定金屬熔點等,現在,它已成為研究合金相圖的主要手段,用熱分析法除可獲得平衡相圖所需的各種數據(如步冷曲線)外,還可得到合金的熱力學數據、判斷亞穩相存在與否以及決定亞穩相的溶解度曲線,
晶體的熔點是很敏銳的,當晶體中摻有少量雜質以後,其熔點範圍會明顯擴大,使得DSC熱譜曲線上的相變吸熱峰的寬度和高度發生明顯的改變,利用這一特點,用DSC法可鑑定化合物的純度,這種方法操作簡便,速度快,用量少,它已成為鑑定有機化合物最有效的方法。
熱滴定也稱為溫度滴定、熱焓滴定等,所採用的手段是滴定熱量計。化學分析所涉及的酸鹼反應、沉澱反應、氧化還原反應和配合反應等,均伴隨有一定的熱效應,當反應一開始,便有熱量產生,當反應終止時,熱效應也隨著結束。滴定熱量計的感溫元件(熱效電阻)熱容很小,能對溫度的變化作出迅速回響,因而量熱滴定可用作化學分析的有效手段,並在冶金、煤炭、造紙、製藥和生物製品等工業方面得到套用。有些化學反應由於平衡常數的限制,在量熱滴定中反應不能完全進行到底,這時,從反應的熱譜曲線中,不僅可獲得有關反應焓的信息,還可得到有關熵變及反應平衡常數的信息。
生物學套用
生物體內所發生的過程往往不但熱效應小,而且非常緩慢,傳統熱量計對這類過程無法進行監測,熱導式微熱量計的出現和完善,使得對生物體內的過程進行量熱測定成為可能,它已用來對生物的活性進行監測。套用熱導式微熱量計還可測定細菌等微生物的生長熱譜、細胞的代謝熱譜和種子發芽過程的能量變化。運用熱動力學的方法,微量熱法可用於酶催化反應的米氏常數和反應焓的測定。
其他
套用專門設計的熱量計可測量雷射束的能量,這種熱量計可以為熱導式或等溫外殼式熱量計,具體的結構形式也因接受能量的方式不同而採用不同的設計。雷射束能量的大小由電能進行標定。
量熱法也可用於微波輻射能的測量,在核能工業領域,量熱法也得到套用。熱量計不但可用來測定放射源的能量,通過測定放射源的輻射能可以確定放射元素的半衰期,用這種方法可以化驗分析放射源中所含的放射元素。
 測定放熱反應熱原理示意圖
測定放熱反應熱原理示意圖
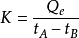
 量熱法原理
量熱法原理 絕熱熱量計原理圖
絕熱熱量計原理圖