配位場理論是說明和解釋配位化合物的結構和性能的理論。在有些配合物中,中心離子(通常也稱中心原子)周圍被按照一定對稱性分布的配位體所包圍而形成一個結構單元。配位場就是配位體對中心離子(這裡大多是指過渡金屬絡合物)作用的靜電勢場。由於配位體有各種對稱性排布,遂有各種類型的配位場,如四面體配位化合物形成的四面體場,八面體配位化合物形成的八面體場等。
簡介
價鍵理論
 配位場理論
配位場理論晶體場理論
 配位場理論
配位場理論分子軌道理論
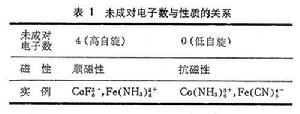
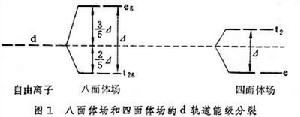
穩定化能
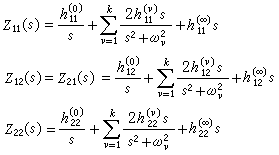 公式
公式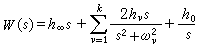 公式
公式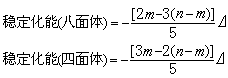 計算
計算分子軌道理論
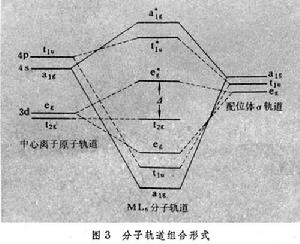 分子軌道組合形式
分子軌道組合形式配位場理論是說明和解釋配位化合物的結構和性能的理論。在有些配合物中,中心離子(通常也稱中心原子)周圍被按照一定對稱性分布的配位體所包圍而形成一個結構單元。配位場就是配位體對中心離子(這裡大多是指過渡金屬絡合物)作用的靜電勢場。由於配位體有各種對稱性排布,遂有各種類型的配位場,如四面體配位化合物形成的四面體場,八面體配位化合物形成的八面體場等。
 配位場理論
配位場理論 配位場理論
配位場理論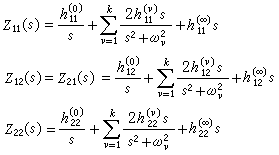 公式
公式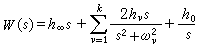 公式
公式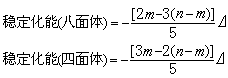 計算
計算 分子軌道組合形式
分子軌道組合形式配位場理論是說明和解釋配位化合物的結構和性能的理論。在有些配合物中,中心離子(通常也稱中心原子)周圍被按照一定對稱性分布的配位體所包圍而形成一個結構單元。...
1.1 配位化合物的結構和成鍵理論的發展簡史?1.2 配位化學的研究內容1.2.1 新型配位化合物的合成1.2.2 配位化合物在溶液中的平衡和反應性能...
隨後,1916年Lewis的共價鍵理論,1923年Sidgwick的有效原子序數法則、1929年Bethe的晶體場理論、1935年VanVleck的配位場理論、1939年Pauling的價鍵理論、1951年Pauson和...
《配位化學:原理與套用》是2009年化學工業出版社出版的圖書,作者是章慧。1...... 《配位化學:原理與套用》是2009年化學...7.2.2 配體場理論在取代反應機理研究...
鄧從豪,理論化學家和教育家,長期從事量子化學和分子反應動力學的理論研究和教育工作。在配位場理論、分子軌道理論、分子反應動力學理論和電子相關理論等研究領域取得了...
9 黃子卿.配位場理論(上).化學通報,1973,(1):45.10 黃子卿.配位場理論(下).化學通報,1973,(2):101.11 黃子卿,楊旦.間硝基苯甲酸在不同溫度的鹽水溶液中...
參加了唐敖慶主持的“配位場理論方法和分子軌道圖形理論”的研究工作,集體獲1982年國家自然科學獎一等獎。在定域分子軌道的計算及其套用、分子振動光譜研究方面又取得...
價鍵理論認為,中心離子(或原子)與配位體以配位鍵形成絡合單元時,中心離子(或原子)提供空軌道,是電子對的接受體。配位體跟具有空的價電子軌道的中心離子或原子...
劉若莊主要從事化學鍵理論及計算量子化學研究。早期曾作氫鍵本質研究和配位場理論方法研究。 [2] 劉若莊於20世紀40年代末開始從事科學研究。 [3] 20世紀50年代中期...
討論班 配位勢場理論的研究(I)——正八面體場中dn組態的理論分析 吉林大學自然科學學報,1964(3):77 Tang Auch,Kiang Yuansun,etal On the Theory of ...
這項研究工作推動了量子化學計算、分子軌道理論及金屬有機化學等在金屬催化研究中的作用。1980年以後,郭燮賢投入到催化研究的工作中,進一步將配位場理論套用於金屬...
可見今天的南京大學已成為我國配位化學研究和人才培養的基地。進行與生產相關聯的基礎理論研究早在1934年,金陵大學就成立了化學研究所,戴安邦任主任,講授膠體化學、...
與唐敖慶等的合作研究成果“配位場理論研究”獲得1982年國家自然科學一等獎 ,與唐敖慶等合著了《配位場理論方法》《分子軌道圖形理論》(科學出版社,1980年)和《...
(前線分子軌道理論,簡稱FMO),Woodward和Hoffmann(分子軌道對稱守恆原理)等眾多科學家的不斷探索,形成了一套成熟的理論,與價鍵理論(VB)和配位場理論(LF)一樣解決...
1929年,貝特等提出配位場理論,最先用於討論過渡金屬離子在晶體場中的能級分裂,後來又與分子軌道理論結合,發展成為現代的配位場理論。...
