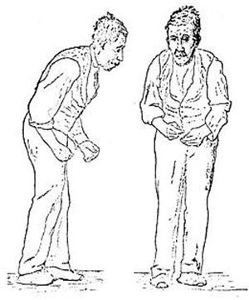
足部震顫是帕金森病的特徵之一。帕金森病又稱特發性帕金森病(idiopathic Parkinson’s disease,PD),簡稱Parkinson病,也稱為震顫麻痹(paralysis agitans,shaking palsy),是中老年人常見的神經系統變性疾病,也是中老年人最常見的錐體外系疾病。主要病變在黑質和紋狀體通路,多巴胺生成減少。65歲以上人群患病率為1000/10萬,隨年齡增高,男性稍多於女性。該病的主要臨床特點:靜止性震顫、動作遲緩及減少、肌張力增高、姿勢不穩等為主要特徵。
基本介紹
- 症狀名稱:足部震顫
- 科室:神經內科
- 部位:下肢
病因,診斷,鑑別,預防,
病因
(一)發病原因
特發性帕金森病(idiopathic Parkinson’s disease)病因迄今未明。某些中樞神經系統變性疾病伴Parkinson病症狀,以中樞神經系統不同部位變性為主,尚有其他臨床特點,故可稱之為症狀性Parkinson病,如進行性核上性麻痹(PSP)、紋狀體黑質變性(SND)、Shy-Drager綜合徵(SDS)及橄欖腦橋小腦萎縮(OPCA)等。還有一些疾病或因素可以產生類似PD臨床症狀,其病因為感染、藥物(多巴胺受體阻滯藥等)、毒物(MPTP、一氧化碳、錳等)、血管性(多發性腦梗死)及腦外傷等所致,臨床上稱為帕金森綜合徵(Parkinson’s syndrome,Palkinsonism)。
迄今為止,PD的病因仍不清楚。目前的研究傾向於與年齡老化、遺傳易感性和環境毒素的接觸等綜合因素有關。
1)年齡老化:帕金森主要發生於中老年人,40歲以前發病少見,提示老齡與發病有關。研究發現,自30歲以後,黑質多巴胺能神經元、酪氨酸氧化酶和多巴脫羧酶活力,紋狀體多巴胺遞質水平隨年齡增長逐漸減少。然而,僅少數老年人患此病,說明生理性多巴胺能神經元蛻變不足以致病,年齡老化只是本病發病的促發因素。
2)環境因素:流行病學調查結果發現,帕金森病的患病率存在地區差異,所以人們懷疑環境中可能存在一些有毒的物質,損傷了大腦的神經元。
3)遺傳易患性。近年在家族性帕金森病患者中曾發現a共同核素基因的Alα53THr突變。但以後多次未被證實。
4)家族遺傳性:醫學家們在長期的實踐中發現帕金森病似乎有家族聚集的傾向,有帕金森病患者的家族其親屬的發病率較正常人群高一些。
目前普遍認為,帕金森並非單一因素,多種因素可能參於其中。遺傳因素可使患病易感性增加,只有與環境因素及衰老的相互作用下,通過氧化應激、線粒體功能衰竭、鈣超載、興奮性胺基酸毒性作用、細胞凋亡、免疫異常等機制才導致黑質多巴胺能神經元大量變性丟失而發病。
(二)發病機制
1.發病機制 十分複雜,可能與下列因素有關。
(1)年齡老化:PD主要發生於中老年,40歲前發病少見,提示老齡與發病有關。研究發現自30歲後黑質DA能神經元、酪氨酸羥化酶(TH)和多巴脫羧酶(DDC)活力、紋狀體DA遞質逐年減少,DAD1和D2受體密度減低。但老年人患PD畢竟是少數,說明生理性DA能神經元退變不足以引起本病。實際上,只有黑質DA能神經元減少50%以上,紋狀體DA遞質減少80%以上,臨床才會出現PD症狀,老齡只是PD的促發因素。
(2)環境因素:流行病學調查顯示,長期接觸殺蟲劑、除草劑或某些工業化學品等可能是PD發病危險因素。20世紀80年代初美國加州一些吸毒者因誤用一種神經毒物質吡啶類衍生物1-甲基4-苯基1,2,3,6-四氫吡啶(MPTP),出現酷似原發性PD的某些病理變化、生化改變、症狀和藥物治療反應等,給猴注射MPTP也出現相似效應。嗜神經毒MPTP和某些殺蟲劑、除草劑可能抑制黑質線粒體呼吸鏈NADH-CoQ還原酶(複合物Ⅰ)活性,使ATP生成減少,自由基生成增加,導致DA能神經元變性死亡。PD黑質區存在明顯脂質過氧化,還原型谷胱甘肽顯著降低,提示抗氧化機制障礙及氧化應激可能與PD有關。
(3)遺傳因素:約10%的患者有家族史,呈不完全外顯的常染色體顯性遺傳或隱性遺傳,其餘為散發性PD。雙胞胎一致性研究顯示,某些年輕(<40歲)患者遺傳因素可能起重要作用。迄今已確定PARK 1~10等10個單基因與PD有關,其中已確認三個基因產物與家族性PD有關:①α-突觸核蛋白為PARK1基因突變,基因定位於4號染色體長臂4q21~23,α-突觸核蛋白可能會增高DA能神經細胞對神經毒素敏感性;②Parkin為PARK2基因突變,定位於6號染色體長臂6q25.2~27;③泛素蛋白C末端羥化酶-L1為PARK5基因突變,定位於4號染色體短臂4p14。細胞色素P45O2D6基因和某些線粒體DNA突變可能是PD發病易感因素之一,可能使P450酶活性下降,使肝臟解毒功能受損,易造成MPTP等毒素對黑質紋狀體損害。
(4)氧化應激和自由基生成:自由基可使不飽和脂肪酸發生脂質過氧化(LPO),後者可氧化損傷蛋白質和DNA,導致細胞變性死亡。PD患者由於B型單胺氧化酶(MAO-B)活性增高,可產生過量OH基,破壞細胞膜。在氧化同時,黑質細胞內DA氧化產物聚合形成神經黑色素,與鐵結合產生Fenton反應可形成OH。正常情況下,細胞內有足夠的抗氧化物質,如腦內的谷胱甘肽(GSH)、谷胱甘肽過氧化物酶(GSH-PX)和超氧化物歧化酶(SOD)等,DA氧化產生自由基不會產生氧化應激,保證免遭自由基損傷。PD患者黑質部還原型GSH降低和LPO增加,鐵離子(Fe2 )濃度增高和鐵蛋白含量降低,使黑質成為易受氧化應激侵襲的部位。
足部震顫 (5)線粒體功能缺陷:近年發現,線粒體功能缺陷在PD發病中起重要作用。對PD患者線粒體功能缺陷認識源於對MPTP作用機制研究,MPTP通過抑制黑質線粒體呼吸鏈複合物Ⅰ活性導致Parkinson病。體外實驗證實MPTP活性成分MPP 能造成MES 23.5細胞線粒體膜電勢(ΔΨm)下降,氧自由基生成增加。PD患者黑質線粒體複合物Ⅰ活性可降低32%~38%,複合物α活性降低使黑質細胞對自由基損傷敏感性顯著增加。在多系統萎縮及進行性核上性麻痹患者黑質中未發現複合物Ⅰ活性改變,表明PD黑質複合物Ⅰ活性降低可能是PD相對特異性改變。PD患者存線上粒體功能缺陷可能與遺傳和環境因素有關,研究提示PD患者存線上粒體DNA突變,複合物Ⅰ是由細胞核和線粒體兩個基因組編碼翻譯,兩組基因任何片段缺損都可影響複合物Ⅰ功能。
(6)興奮性毒性作用:有作者套用微透析及HPLC檢測發現,由MPTP製備的PD猴模型紋狀體中興奮性胺基酸(谷氨酸、天門冬氨酸)含量明顯增高。若細胞外間隙谷氨酸濃度異常增高,會過度刺激受體,對CNS產生明顯毒性作用。動物實驗發現,腦內注射微量谷氨酸可導致大片神經元壞死,谷氨酸神經毒作用是通過受體起作用,NMDA受體介導興奮性神經毒作用與DA能神經元變性有關。谷氨酸可通過激活NMDA受體產生一氧化氮(NO)損傷神經細胞,並釋放更多興奮性胺基酸,進一步加重神經元損傷。
(7)鈣的細胞毒作用:人類衰老可伴神經細胞內游離Ca2 濃度增加、Ca2 /Mg2 -ATP酶活性降低,線粒體儲鈣能力降低等。細胞內Ca2 濃度變化影響神經元多項重要功能,如細胞骨架維持、神經遞質功能、蛋白質合成及Ca2 介導酶活性等,鈣結合蛋白尤其28KD維生素D依賴性鈣結合蛋白(Calbindin-D28K)可能扮演重要角色,與鈣/鎂-ATP酶激活有關,具有神經保護作用。Icopini和Christakos等報導,PD患者黑質、海馬、縫背側核Calbindin-D28K含量及mRNA表達明顯低於正常人,提示鈣結合蛋白基因表達降低也可導致細胞毒作用。
(8)免疫學異常:Abramsky(1978)提出PD發病與免疫異常有關。臨床研究發現PD患者細胞免疫功能降低,白細胞介素-1(IL-1)活性降低明顯。McRae-Degueurce等報導PD患者腦脊液(CSF)存在抗DA能神經元抗體。細胞培養發現,PD血漿及CSF抑制大鼠中腦DA能神經元功能及生長。將PD患者血IgG立體定向注入大鼠一側黑質,黑質酪氨酸羥化酶(TH)及DA能神經元明顯減少,提示可能啟動或參與免疫介導的黑質細胞損傷。腫瘤壞死因子-α(TNF-α)、IL-6、上皮生長因子(EGF)、轉移生長因子-α(TGF-α)和β2-微球蛋白(β2-MG)等可能與PD發病有關。
(9)細胞凋亡:研究表明,PD發病過程存在細胞凋亡,自由基、神經毒素及神經營養因子缺乏等。Agid(1995)檢測PD患者黑質DA能神經元凋亡形態學和生化特徵,發現PD患者腦內約5能神經元有細胞凋亡特徵性病變,存在TNF-α受體(α-TN-FR)和bcl-2原癌基因表達,細胞凋亡可能是DA能神經元變性的基本步驟。
目前普遍認為,PD並非單一因素致病,可能多種因素參與。遺傳因素使患病易感性增加,在環境因素及年齡老化共同作用下,通過氧化應激、線粒體功能衰竭、鈣超載、興奮性胺基酸毒性及細胞凋亡等機制引起黑質DA能神經元變性,導致發病。
2.病理改變 PD主要病變是含色素神經元變性、缺失,黑質緻密部DA能神經元最顯著。鏡下可見神經細胞減少,黑質細胞黑色素消失,黑色素顆粒游離散布於組織和巨噬細胞內,伴不同程度神經膠質增生。正常人黑質細胞隨年齡增長而減少,黑質細胞80歲時從原有42.5萬減至20萬個,PD患者少於10萬個,出現症狀時DA能神經元丟失50%以上,藍斑、中縫核、迷走神經背核、蒼白球、殼核、尾狀核及丘腦底核等也可見輕度改變。
殘留神經元胞漿中出現嗜酸性包涵體路易(Lewy)小體是本病重要病理特點,Lewy小體是細胞漿蛋白質組成的玻璃樣團塊,中央有緻密核心,周圍有細絲狀暈圈。一個細胞有時可見多個大小不同的Lewy小體,見於約10%的殘存細胞,黑質明顯,蒼白球、紋狀體及藍斑等亦可見,α-突觸核蛋白和泛素是Lewy小體的重要組分。
3.神經生化改變 DA和乙醯膽鹼(Ach)作為紋狀體兩種重要神經遞質,功能相互拮抗,維持兩者平衡對基底節環路活動起重要調節作用。腦內DA遞質通路主要為黑質-紋狀體系,黑質緻密部DA能神經元自血流攝入左旋酪氨酸,在細胞內酪氨酸羥化酶(TH)作用下形成左旋多巴(L-dopa);再經多巴胺脫羧酶(DDC)作用生成多巴胺(DA);通過黑質-紋狀體束,DA作用於殼核、尾狀核突觸後神經元,最後被分解成高香草酸(HVA)。
由於特發性帕金森病TH和DDC減少,使DA生成減少(左旋酪氨酸生成L-dopa減少,DA生成減少)。單胺氧化酶B(MAO-B)抑制可劑減少神經元內DA分解代謝,增加腦內DA含量。兒茶酚-氧位-甲基轉移酶(COMT)抑制劑能減少L-dopa外周代謝,維持L-dopa穩定的血漿濃度。
PD患者黑質DA能神經元變性丟失、黑質-紋狀體DA通路變性,紋狀體DA含量顯著降低(>80%),使Ach系統功能相對亢進,是導致肌張力增高、動作減少等運動症狀的生化基礎。近年發現中腦-邊緣系統和中腦-皮質系統DA含量亦顯著減少,可能導致智慧型減退、行為情感異常、言語錯亂等高級神經活動障礙。DA遞質減少程度與患者症狀嚴重度一致,病變早期通過DA更新率增加(突觸前代償)和DA受體失神經後超敏現象(突觸後代償),臨床症狀可不明顯(代償期),隨疾病進展出現典型PD症狀(失代償期)。基底節其他遞質或神經肽,如去甲腎上腺素(NE)、5-羥色胺(5-HT)、P物質(SP)、腦啡肽(ENK)、生長抑素(SS)也有變化。
診斷
臨床表現
PD通常發病於40~70歲,60歲後發病率增高,30多歲前發病少見,在一組380例PD患者中僅4例;男性略多。起病隱襲,發展緩慢,主要表現靜止性震顫、肌張力增高和運動遲緩等,症狀出現孰先孰後因人而異。首發症狀震顫最多(60%~70%),其次為步行障礙(12%)、肌強直(10%)和運動遲緩(10%)。症狀常自一側上肢開始,逐漸波及同側下肢、對側上肢及下肢,呈“N”字型進展(65%~70%);25%~30%的病例可自一側下肢開始,兩側下肢同時開始極少見,不少病例疾病晚期症狀仍存在左右差異。
但不論如何治療,慢性進展性病程、數年後多數患者需要幫助是其固有的臨床特點。根據PD的典型表現及對多巴藥物的正性反應,一般可以做出明確的診斷。但是,對於某些亞臨床症狀或非典型病例在早期確難以認識,而早期確診、早期治療對後期生活質量有著重要影響,這也是目前臨床學界研究的重點。對於大部分患者和臨床醫師來說,很難肯定和判定PD的發病日期、首發症狀,以及確定動作緩慢、震顫症狀出現的時間。據國內李大年等的報告,推測PD的臨床前期症狀可能有3~5年之久,為此,可將PD症狀分為臨床前期症狀和臨床期症狀兩個階段。
1.臨床前期症狀 最早提出臨床前期症狀僅見於Fletcher(1973)等人的報告,但他們提出的這些症狀至今尚未得到人們的重視。這些症狀主要包括以下兩方面:
(1)感覺異常:事實上早在Parkinson《震顫麻痹》一書中就描述“部分PD病例在其運動症狀出現之前可出現風濕樣疼痛”,同年Charcot也對2例PD患者作了同樣的描述。直到20世紀70年代,Fletcher和Snider等人才對PD的臨床前期症狀及感覺障礙作了比較詳細的描述。到20世紀80年代,William等人結合電生理學對感覺障礙進行了分類,他報告的感覺症狀主要表現為患肢關節處無緣由的麻木、刺痛、蟻行感和燒灼感,以腕、踝處為主,開始多為間歇性或遊走性,後期表現為固定性。常規神經系統查體無明顯客觀感覺異常,電生理檢查可見部分病例的體感誘發電位(SEP),特別是下肢的潛伏期和傳導時間延長。到20世紀90年代初,我們對150例患者作了回顧性調查,結果是全部患者不同程度的在PD臨床症狀出現前體驗過患肢感覺異常,而且這種異常可一直持續下去,但與運動障礙不成平行關係。電生理檢查主要是體感、皮質誘發電位有皮質延擱(centre delay)和傳導延遲及潛伏期延長。
表1——IPD診斷和刪除標準 (2)不寧肢與易疲憊:除主觀感覺異常外,約1/2患者在早期曾體驗過患肢難以描述的酸、脹、麻木或疼痛等不適感,而且這種不適感多在勞累後的休息時發生或明顯,經敲、捶打後可緩解,酷像不寧腿綜合徵的表現。另則,部分患者的患肢易出現疲勞感,特別是上肢的腕關節、肩關節,下肢的踝關節和膝關節,當勞累後這些部位可出現難以發現的輕微震顫。對這些症狀開始時服用一般鎮痛藥可有效,數月後則無作用。此時服用多巴藥物後可出現明顯療效。

2.臨床期症狀 首發症狀存在著明顯個體差異,有報告統計主觀感覺異常為85%、震顫為70.5%、肌僵直或動作緩慢為19.7%、失靈巧和(或)寫字障礙為12.6%、步態障礙為11.5%、肌痛痙攣和疼痛為8.2%、精神障礙如抑鬱和焦慮緊張等為4.4%、語言障礙為3.8%、全身乏力或肌無力為2.7%、流口水和面具臉各為1.6%。
(1)靜止性震顫(static tremor):常為PD首發症狀,少數患者尤其70歲以上發病者可不出現震顫。其機制是受累肌群與拮抗肌群規律性、交替性不協調活動所致。早期常表現在肢體遠端,始於一側,以上肢的手部震顫為多見,部分患者始於下肢的膝部。當伴有旋轉的成分參與時,可出現拇指、示指搓丸樣震顫。震顫頻率一般在4~8Hz,靜止時出現,大力動作時停止,緊張時加劇,睡眠時消失。經數年後累及到同側上下肢或對側,嚴重者可出現頭部、下頜、口唇、舌、咽喉部以及四肢震顫。令患者活動一側肢體如握拳或松拳,可引起另側肢體出現震顫,該試驗有助於發現早期輕微震顫。後期除靜止性震顫外,部分患者可合併動作性或姿勢性震顫。
(2)肌強直(rigidity):肌強直是PD的主要症狀之一,主要是由於主動肌和拮抗肌均衡性張力增高所致。如果在被動運動中始終存在,則被稱之為“鉛管樣強直或張力”,若同時伴有震顫時,被動運動時可感到有齒輪樣感覺,則稱之為“齒輪樣強直或張力”。肌強直最早發生在患側的腕、踝,特別是患者勞累後,輕緩的被動運動腕、踝關節時可感到齒輪樣肌張力增高。由於肌張力的增高,可給患者帶來一系列的異常症狀,如瞬目、咀嚼、吞咽、行走等動作減少。
以下臨床試驗有助於發現輕微肌強直:①令患者運動對側肢體,被檢肢體肌強直可更明顯;②頭墜落試驗(head dropping test):患者仰臥位,快速撤離頭下枕頭時頭常緩慢落下,而非迅速落下;③令患者把雙肘置於桌上,使前臂與桌面成垂直位,兩臂及腕部肌肉儘量放鬆,正常人此時腕關節與前臂約成90°屈曲,PD患者腕關節或多或少保持伸直,儼若豎立的路標,稱為“路標現象”。老年患者肌強直引起關節疼痛,是肌張力增高使關節血供受阻所致。
(3)運動遲緩(bradykinesia):表現隨意動作減少,包括始動困難和運動遲緩,因肌張力增高、姿勢反射障礙出現一系列特徵性運動障礙症狀,如起床、翻身、步行和變換方向時運動遲緩,面部表情肌活動減少,常雙眼凝視,瞬目減少,呈面具臉(maskedface),手指精細動作如扣紐扣、繫鞋帶等困難,書寫時字愈寫愈小,為寫字過小征(micrographia)等。
PD患者的運動緩慢或不能是致殘的主要原因。過去認為PD的運動不能是由於肌強直所致,事實上兩者並無因果關係。現已初步證明,PD的運動減少和不能是一個很複雜的症狀,它主要和皮質下錐體外系的驅動裝置功能或錐體外系下行運動激活裝置障礙有關。因為對運動不能的患者進行手術治療後,肌強直症狀明顯改善,但其運動頻度並非像服用多巴藥物後成一致性改善。
(4)姿勢步態異常:姿勢反射障礙是帶給PD患者生活困難的主要症狀,它僅次於運動減少或運動不能。患者四肢、軀幹和頸部肌強直呈特殊屈曲體姿,頭部前傾,軀幹俯屈,上肢肘關節屈曲,腕關節伸直,前臂內收,指間關節伸直,拇指對掌;下肢髖關節與膝關節均略呈彎曲,早期下肢拖曳,逐漸變為小步態,起步困難,起步後前沖,愈走愈快,不能及時停步或轉彎,稱之為“慌張步態”(festination),行走時上肢擺動減少或消失;轉彎時因軀幹僵硬,軀幹與頭部聯帶小步轉彎,與姿勢平衡障礙導致重心不穩有關。患者害怕跌倒,遇小障礙物也要停步不前。隨疾病進展姿勢障礙加重,晚期自坐位、臥位起立困難。目前對PD患者這種固有的姿勢反射障礙的機制尚無明確解釋,有人認為該症狀主要與蒼白球經丘腦至皮質的傳出環路損害有關。
(5)其他症狀:
①反覆輕敲患者眉弓上緣可誘發眨眼不止(Myerson征),正常人反應不持續;可有眼瞼陣攣(閉合眼瞼輕度顫動)或眼瞼痙攣(眼瞼不自主閉合)。
②口、咽、齶肌運動障礙,使講話緩慢,語音低沉單調,流涎等,嚴重時吞咽困難。
③常見皮脂腺、汗腺分泌亢進引起脂顏(oily face)、多汗,消化道蠕動障礙引起頑固性便秘,交感神經功能障礙導致直立性低血壓等,括約肌功能不受累。
④精神症狀以抑鬱多見,可出現焦慮、激動,部分患者晚期出現輕度認知功能減退、視幻覺,通常不嚴重。
3.PD的臨床分類與分型 王新德執筆,1984年10月全國錐體外系會議制定。
(1)原發性(特發性帕金森病,即震顫麻痹):
①按病程分型:
A.良性型:病程較長,平均可達12年運動症狀波動和精神症狀出現較遲。
B.惡性型:病程較短,平均可達4年。運動症狀波動和精神症狀出現較早。
②按症狀分型:
A.震顫型。
B.少動和強直型。
C.震顫少動和強直型伴痴呆型。
D.震顫少動和強直型不伴痴呆型。
③按遺傳分型:
A.家族性帕金森病。
B.少年型帕金森病。
(2)繼發性(帕金森綜合徵、症狀性帕金森綜合徵):
①感染性(包括慢性病毒感染)腦炎後帕金森綜合徵(嗜睡性腦炎、其他腦炎等)。
②中毒性(一氧化碳、錳、二硫化碳、氫化物、甲醇等)。
③藥物性(抗精神病藥物如吩噻嗪類、丁醯苯類、蘿芙木生物鹼及α-甲基多巴等)。
④腦血管病變。
⑤腦腫瘤(特別是腦部中線腫瘤)。
⑥腦外傷。
⑦中腦空洞。
⑧代謝性(甲狀腺功能減退、基底節鈣化、慢性肝腦變性等)。
(3)症狀性帕金森綜合徵(異質性系統變性):
①進行性核上性麻痹。
②紋狀體黑質變性。
③皮質齒狀核黑質變性。
④橄欖腦橋小腦萎縮。
⑤Shy-Drager位置性低血壓綜合徵。
⑥痴呆[關島帕金森-痴呆-肌萎縮性側索硬化綜合徵,Jacob-Creutfeldt病(皮質紋狀體脊髓變性),Alzheimer及Pick病,正常顱壓腦積水]。
⑦遺傳性疾病(肝豆狀核變性、Hallerrorden-Spatz病、Huntington病、脊髓小腦黑質變性等)。
診斷
1.診斷依據
(1)中老年發病,緩慢進行性病程。
(2)四項主征(靜止性震顫、肌強直、運動遲緩、姿勢步態障礙)中至少具備2項,前兩項至少具備其中之一,症狀不對稱。
表2——診斷不斷階段的IPD標準 (3)左旋多巴治療有效,左旋多巴試驗或阿朴嗎啡試驗陽性支持原發性PD診斷。

(4)患者無眼外肌麻痹、小腦體徵、體位性低血壓、錐體系損害和肌萎縮等。PD臨床診斷與屍檢病理證實符合率為75%~80%。
2.國內外常用的診斷與鑑別診斷標準
(1)原發性帕金森病(IPD)的診斷:王新德執筆1984年10月全國錐體外系會議制定的標準如下:
①至少要具備下列4個典型的症狀和體徵(靜止性震顫、少動、僵直、位置反射障礙)中的2個。
②是否存在不支持診斷IPD的不典型症狀和體徵,如錐體束征、失用性步態障礙、小腦症狀、意向性震顫、凝視麻痹、嚴重的自主神經功能障礙、明顯的痴呆伴有輕度錐體外系症狀。
③腦脊液中高香草酸減少,對確診早期帕金森病(PD)和特發性震顫(ET)、藥物性帕金森綜合徵與PD是有幫助的。
一般而言,ET有時與早期IPD很難鑑別,ET多表現為手和頭部位置性和動作性震顫而無肌張力增高和少動。
(2)繼發性帕金森綜合徵(SPDS)的診斷:
①藥物性PS(MPS):藥物性PS與IPD在臨床上很難區別,重要的是依靠是否病史上有無服用抗精神病藥物史。另外,藥物性PS的症狀兩側對稱,有時可伴有多動症側會先出現症狀。若臨床鑑別困難時,可暫停套用抗精神病藥物,假若是藥物性,一般在數周至6個月PS症狀即可消失。
②血管性PS(VPS):該征的特點為多無震顫,常伴有局灶性神經系統體徵(如錐體束征、假性球麻痹、情緒不穩等),病程多呈階梯樣進展,L-多巴製劑治療一般無效。
(3)症狀性帕金森病綜合徵(異質性系統變性)的診斷:
①進行性核上性變性:有時與帕金森病很難鑑別。進行性核上性麻痹的臨床特點主要為動作減少,頸部強直並稍後仰及假性延髓麻痹和向上凝視麻痹。
②橄欖腦橋小腦萎縮:原發性帕金森病應與本病進行鑑別。橄欖腦橋小腦變性臨床也可表現為少動、強直、甚至靜止性震顫。但多同時有共濟失調等小腦症狀。CT檢查亦可見特徵性的改變。血谷氨酸脫羧酶活力減低。
③紋狀體黑質變性:本病與原發性帕金森病很想像,臨床上很難鑑別,主要依靠病理診斷。若臨床上L-多巴治療無效時,應考慮紋狀體黑質變性可能。
④Shy-Drager位置性低血壓綜合徵:臨床表現為位置性低血壓、大小便失禁、無汗、肢體遠端小肌肉萎縮等。有時也可伴有帕金森病綜合徵。若臨床發現患者有帕金森病綜合徵和輕度自主神經障礙症狀,就需要與原發性帕金森病鑑別。
⑤痴呆:痴呆伴有帕金森綜合徵不罕見。A.Alzheimer病:晚期Alzheimer病除痴呆外,尚有錐體外系症狀,如少動、強直和口面多動。另外由於帕金森病甚至早期也可伴有痴呆,因此需依靠隨訪對兩者進行鑑別;B.正常顱壓腦積水:本病表現為步態障礙、尿失禁和痴呆。有時也可出現帕金森病的症狀,如少動、強直、和靜止性震顫等。CT檢查對鑑別有幫助。放射性核素腦池造影對診斷正常顱壓腦積水也有重要意義。
⑥遺傳變性疾病:
A.蒼白球-黑質色素變性病(Hallervorden-Spatz disease)。
B.Huntinton舞蹈病。
C.Lubag(X-連肌張力失常-PDS)。
D.線粒體細胞病伴紋狀體壞死。
E.神經棘紅細胞增多症(β-脂蛋白缺乏症)。
F.肝豆狀核變性(Wilson病)。
原發性PD在這些臨床類型中占總數75%~80%;繼發性(或症狀性)PD相對少見;遺傳變性病與帕金森疊加綜合徵占10%~15%。
對大多數已有明顯的動作緩慢、減少、肌強直、震顫的中老年患者均會被考慮到IPD,而對那些早期或症狀不典型的病例有時確會被誤診。為此,Takahashi等(1992)和Calne等(1992)提出原發性帕金森病(IPD)早期診斷的必要條件和刪除條件的初步標準(表1、2)。
鑑別
特發性PD須與家族性PD、Parkinson綜合徵鑑別,早期不典型病例須與遺傳病或變性病伴Parkinson綜合徵鑑別。
1.家族性PD 約占10%,為不完全外顯率常染色體顯性遺傳,可用DNA印跡技術、PCR和DNA序列分析等,檢測α-突觸核蛋白基因、Parkin基因突變,易感基因分析如細胞色素P450-2D6基因突變等。
2.Parkinson綜合徵 有明確病因,繼發於藥物、感染、中毒、腦卒中和外傷等。
(1)腦炎後Parkinson綜合徵:20世紀上半葉流行的昏睡性(von Economo)腦炎常遺留帕金森綜合徵,目前罕見。
(2)藥物或中毒性Parkinson綜合徵:神經安定劑(酚噻嗪類及丁醯苯類)、利血平、胃復安、α-甲基多巴、鋰、氟桂嗪等可導致帕金森綜合徵;MPTP、錳塵、CO、二硫化碳中毒或焊接煙塵亦可引起。
(3)動脈硬化性Parkinson綜合徵:多發性腦梗死偶導致Parkinson綜合徵,患者有高血壓、動脈硬化及腦卒中史,假性球麻痹、病理征和神經影像學檢查可提供證據。
(4)外傷性如拳擊性腦病,其他如甲狀腺功能減退、肝腦變性、腦瘤和正常壓力性腦積水等可導致Parkinson綜合徵。
3.遺傳病伴Parkinson綜合徵
(1)彌散性路易體病(diffuse Lewis body disease,DLBD):多見於60~80歲,痴呆、幻覺、帕金森綜合徵運動障礙為臨床特徵,痴呆早期出現,進展迅速,可有肌陣攣,左旋多巴反應不佳,但副作用極敏感。
(2)肝豆狀核變性(Wilson病):可引起帕金森綜合徵,青少年發病,一或兩側上肢粗大震顫,肌強直、動作緩慢或不自主運動,肝損害和角膜K-F環,血清銅、銅藍蛋白、銅氧化酶活性降低,尿銅增加等。
(3)亨廷頓(Huntington)病:運動障礙以肌強直、運動減少為主,易誤診為PD。
4.變性病伴Parkinson綜合徵
(1)多系統萎縮(MSA):累及基底節、腦橋、橄欖、小腦及自主神經系統,可有PD樣症狀,對左旋多巴不敏感。
包括:紋狀體黑質變性(SND),表現運動遲緩、肌強直,可有錐體系、小腦和自主神經症狀,震顫不明顯。 Shy-Drager綜合徵(SDS),自主神經症狀突出,直立性低血壓、無汗、排尿障礙和陽萎,以及錐體束、下運動神經元和小腦體徵等。橄欖腦橋小腦萎縮(OPCA),小腦及錐體系症狀突出,MRI顯示小腦和腦幹萎縮。
(2)進行性核上性麻痹(PSP):可有運動遲緩和肌強直,早期姿勢步態不穩和跌倒,垂直凝視不能,伴額顳痴呆、假性球麻痹、構音障礙及錐體束征,震顫不明顯,左旋多巴反應差。
(3)皮質基底節變性(CBGD):表現肌強直、運動遲緩、姿勢不穩、肌張力障礙和肌陣攣等,可有皮質複合感覺缺失、一側肢體忽略、失用、失語和痴呆等皮質損害症狀,眼球活動障礙和病理征,左旋多巴治療無效。
足部震顫 (4)Alzheimer病伴Parkinson綜合徵。
(5)抑鬱症:可有表情貧乏、言語單調、自主運動減少,PD患者常並存。抑鬱症無肌強直和震顫,抗抑鬱藥試驗治療可能有助於鑑別。
(6)特發性震顫:多早年起病,姿勢性或動作性震顫,影響頭部引起點頭或搖晃,PD典型影響面部、口唇。本病無肌強直和運動遲緩,約1/3的患者有家族史,飲酒或服心得安震顫明顯減輕。
預防
迄今,帕金森病確切病因尚不十分清楚,因此,預防措施缺乏精確的針對性。但許多研究已證實,本文上述諸多危險因素與中腦黑質多巴胺神經元變性、壞死存在著一定的因果關係,若能針對危險因素採取相應的預防措施,對預防帕金森病的發病和延緩病程進展肯定是有益的。
一級預防(無病防病)
1、對有帕金森病家族史及有關基因攜帶者,有毒化學物品接觸者,均應視為高危人群,須密切監護隨訪,定期體檢,並加強健康教育,重視自我防護。
2、加大工農業生產環境保護的力度,減少有害氣體、污水、污物的排放,對有害作業人員應加強勞動防護。
3、改善廣大農村及城鎮的飲水設施,保護水資源,減少河水、庫水、塘水及井水的污染,保證廣大人民民眾能喝上安全衛生的飲用水。
4、老年人慎用吩噻嗪類、利血平類及丁醯苯類藥物。
5、重視老年病(高血壓、高血脂、高血糖、腦動脈硬化等)的防治,增強體質,延緩衰老,防止動脈粥樣硬化,對預防帕金森病均能起到一定的積極作用。
二級預防(早發現、早診斷、早治療)
1、早期診斷。帕金森病的亞臨床期長,若能即早開展臨床前期診斷技術,如嗅覺機能障礙、PET掃描、線粒體DNA、多巴胺抗體、腦脊液化學、電生理等檢查,將亞臨床期帕金森病儘早發現,採用神經保護劑(如維生素E、SOD、谷胱甘肽及谷胱甘肽過氧化物酶、神經營養因子、塞利吉林)治療,可能會延緩整個臨床期的過程。
2、帕金森病早期,雖然黑質和紋狀體神經細胞減少,但多巴胺分泌卻代償性增加,此時腦內多巴胺含量並未明顯減少,稱代償期,一般不主張用藥物治療,可採用理療、醫療體育、太極拳、水療、按摩、氣功、針灸等治療,以維持日常一般工作和生活,儘量推遲抗震顫麻痹藥物套用的時間。但也有人主張早期套用小劑量左旋多巴以減少併發症,這要因人而異,擇優選用。
3、帕金森病失代償期應使用藥物治療。
三級預防(延緩病情發展、防止病殘、改善生活質量)
1、積極進行非藥物如理療、體療、針灸、按摩等及中西醫藥物或手術等綜合治療,以延緩病情發展。
2、重視心理疏導安撫和精神關愛,保證充足睡眠,避免情緒緊張激動,以減少肌震顫加重的誘發因素。
3、積極鼓勵患者主動運動,如吃飯、穿衣、洗漱等。有語言障礙者,可對著鏡子努力大聲地練習發音。加強關節、肌力活動及勞作訓練,儘可能保持肢體運動功能,注意防止摔跤及肢體畸形殘廢。
4、長期臥床者,應加強生活護理,注意清潔衛生,勤翻身拍背,防止墜積性肺炎及褥瘡感染等併發症,帕金森病大部分死於肺部或其他系統如泌尿系統等的感染。注意飲食營養,必要時給予鼻飼,保持大小便通暢。以不斷增強體質,提高免疫功能,降低死亡率。

